8.Дифференциальные уравнения и критерии подобия процессов массообмена в системах без твердой фазы
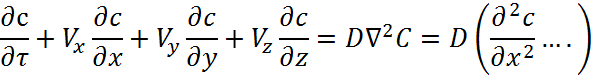
C-концентрация вещества в потоке
Vx, Vy, Vz – компоненты скорости потока вдоль осей координат
D – коэффициент диффузии
![]() оператор Лапласа
оператор Лапласа
D![]() = β(C-Cp) – уравнение
для граничных условий
= β(C-Cp) – уравнение
для граничных условий
При решении этих ур-й методами теории подобия получ. след диффузионные критерии:
1. Критерий Нуссельта
Nuд=![]()
2. Критерий Прандтля
Prд=ν/D
3. Критерий Пекле
Peд=V*l/D
4. Критерий Фурье
Fод=D*τ/l2
5. Критерий Био
Biд=β*l/ D
Общий вид критериального ур-я массообмена:
Nuд=A*Ren*Prдm*Fодp
Re=V*l/ν
A, m, n, p- опытные коэффициенты
Зная эту з-ть для процесса массообмена и конкретные условия проведения п-са, расчитываются диффузионным критерием Нуссельта, а по нему определяют к-т массоотдачи β.
9.Материальный баланс процесса массообмена
Для большинства процессов массообмена в аппаратах непрерывного действия происходит встроенное движение потоков.
Уравнение баланса:
Mx(xк-x) = My(yм-y) (1)
Mx, My – масса x-ж.ф., y – г.ф. [кмоль]
xк – конечная молярная концентрация ж.ф.
x – текущая молярная концентрация ж.ф.
yн – начальная молярная концентрация г.ф.
y – текущая молярная концентрация г.ф.
Выразим из уравнения y:
Y=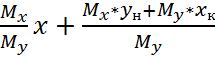 (2)
(2)
Уравнение (2) характеризует изменение концентрации вещества в газовой или паровой фазе при изменении концентрации веществ в жидкой фазе и называется уравнением рабочей линии процесса.
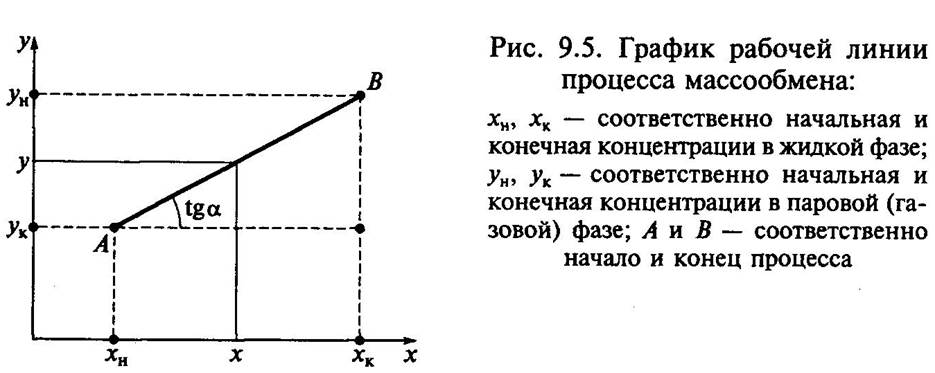
Отношение Lx=Mx/My=tgα называется удельным расходом жидкой фазы.
Расход жидкой фазы определяют по уравнению материального баланса:
Mx=My*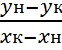
В случае переменных значений x и y линия рабочего процесса криволинейна
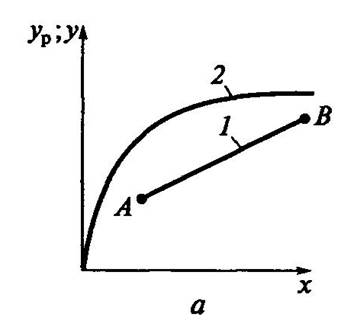
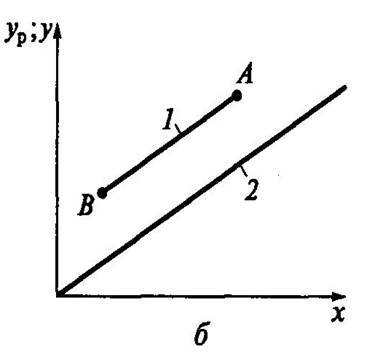
Система- пар -жидкость Система газ-жидкость
Точки A и B начало и конец процесса. Обычно при расчетах процесса массообмена на одной диаграмме строят одновременно равновесную и рабочую линию процесса. Рабочая линия может располагаться выше или ниже равновесной в зависимости от разности равновесных и рабочих концентраций вещества.
10.Движущая сила процесса массообмена
Определяется разностью между рабочей и равновесной концентрации вещества поэтому силу Δy или Δx можно выразить через концентрацию вещества в любой фазе:
Δy = yр- y или Δy=y-yр
Δx=x-xр или Δx=xр –x
Обычно движущая сила изменяется от начального значения до конечного:
![]() Δyн Δyк
Δyн Δyк
Для каждого процесса в пределах изменения концентрации можно определить среднюю движущую силу. Если равновесная зависимость между концентрацией вещества фаза задана графически в виде кривой равновесия yр=f(x), рабочая линия имеет уравнение y=Ax+B, то совместное уравнение массообмена и материального баланса для произвольной концентрации y и x записывается в виде:
dM=Ky(yр-y)dSnτ=Mydy (1)
dM-количество вещества передаваемого из газовой фазы в жидкую
Ky-коэффициент массопередачи из газовой фазы в жидкую
Yр-равновесная концентрация в газовой фазе
Y –текущая концентрация в газовой фазе
My – количество газовой фазы
dy – изменение молярной доли вещества на поверхности газового контакта dSn
τ-время процесса
Определим из уравнения 1 площадь поверхности фазового контакта:
Sn=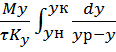 получим
получим
Sn=![]()
![]() средняя движущая сила массопередачи
средняя движущая сила массопередачи
Высоту любого массообменного аппарата можно вычислить по формуле :
ha=![]()
Ky-коэффициент массопередачи [кг/м2с]
Sc – площадь сечения [м2]
f-удельная поверхность соприкосновения фаз
Sc*f – площадь поверхности фазового контакта в аппарате
Высоту эквивалентную одной единице переноса вещества к эквиваленту рассчитывается по формуле:
hэкв=My/KyScf
Если равновесная зависимость криволинейная, то число единиц определяют по формуле:
my= ![]()
Этот приведенный интеграл находят графически:
1. Строят равновесную кривую и рабочую линию
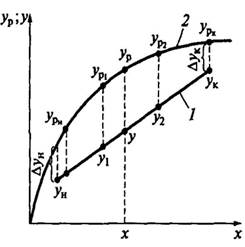
1-равновесная кривая
2-рабочая линия
2. Разность концентрации yн-yк делят произвольно на ряд значений
3. Для каждого y находят y равновесное
4. Находят значение 1/yрн-yн, 1/yр1-y1 и т.д.
5. Строят график зависимости f(y)=1/yр-y
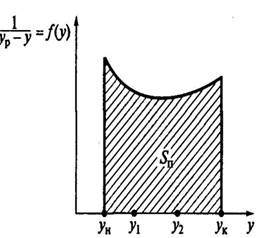
6. Определяют Sn под кривой
7. Рассчитывают число единиц переноса вещества
my=Sn*μy*μ1/yр-y
Если равновесная зависимость между молярными долями вещества в фазах линейная то:
my=![]()
Aр- tg угла наклона к оси абсцисс равновесной линии
A – tg рабочей линии
Для реального расчета пользуются формулой:
my=![]()
11.Перегонка жидкостей
Характеристика процесса перегонки:
Перегонкой называется-процесс разделения жидких однородных смесей состоящих из 2-х и более компонентов. В основе процесса лежит различная испаряемость (летучесть) компонентов смеси при одной и той же температуре.
Компоненты разделяемой смеси должны быть взаиморастворимыми и иметь разные температуры кипения. При перегонке происходит частичное испарение разделяемой смеси и последующая конденсация образующихся паров. Простейшей исходной смесью является бинарная смесь из двух компонентов. Один из компонентов называется легко летучим (нк-низкокипящим), второй вк-высококипящим компонентом. В результате разделения в исходной смеси выделяются 2 продукта дистиллят или ректификат. 2-х компонентный кубовый остаток или кубовая жидкость. В дистилляте содержится больше нк, в кубовой вк. В названии бинарных смесей на 1-ое место ставится нк, на второе вк. Например:
1) Этанол нк-вода вк
2) Вода нк-уксусная кислота вк
3) Атилацетат нк-вода вк
Виды перегоки:
Перегонка как способ разделения однородных смесей делится на 2 вида:
-простая перегонка-дистилляция
-ректификация
Простая представляет собой процесс однократного частичного использования жидкой смеси и конденсации образующихся паров. Применяют в тех случаях когда летучести компонентов сильно различаются те обладают большой разностью температуры кипения. В основном используют для предварительного разделения так как получить в чистом виде компоненты этой смеси невозможно. Относятся:
Перегонка с водяным паром и молекулярная дистилляция.
Ректификация – это многократный процесс частичного использования жидкости и конденсации образующегося пара. В аппаратах обычно происходит противоточное движение жидкости и пара и контакт между ними. При каждом контакте из жидкости испаряется нк которым обогащаются пары а из паров конденсируется вкпереходящий в жидкость. Пары обычно поднимаются ввеох а жидкость стекает вниз. Конденсация из паров представляет собой готовый продукт содержащий в основном нк называемый дистиллятом или ректификат. Внизу аппарата собирается кубовый остаток состоящий из вк.
Применяется в химической, нефтехимической, в производстве спиртов, уксусной кислоты, стирола для разделения газовых смесей после их сжижения.
Жидкость, полученная в результате конденсации паров и обогащенная более летучим компонентом, называется дистиллятом, а неиспарившаяся часть жидкости, содержащая больше труднолетучего компонента, - кубовым остатком.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.