Т2 = Т1 / εn-1 = 325 / 0,61,15-1 = 350,88 К
Термодинамическая работа
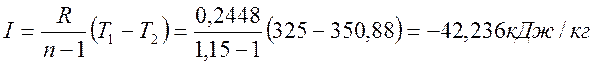
Изменение внутренней энергии
ΔU=CVCM · (Т2- Т1)= 0,84 • (350,88-325) = 21,739 кДж/кг
Изменение энтальпии
Δi = Cpсм • (Т2 – Т1)= 1,085 • (350,88 - 325)= 28,08 кДж/кг
Теплота процесса
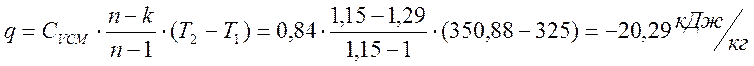
Изменение энтропии
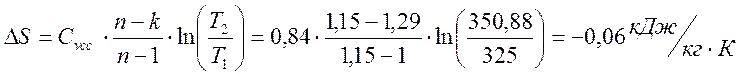
Коэффициент распределения энергии
α = ΔU/ q = 21,739 / -20,29 = 1,071
Потенциальная работа
IП= I · n = -42,236·1,15 = -48,571 кДж/кг
По первому закону термодинамики
q=I +ΔU= -42,236 + 21,739 = -20,497 кДж/кг
Относительная ошибка
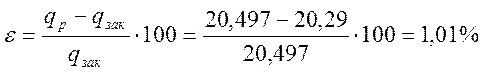
При n5 = k = 1,29 процесс является адиабатным
Конечное давление
P2 = P1 / εk =1,1·105/ 0,61,29 =2.126·105 Па
Конечная температура
Т2 = Т1 / εk-1 = 325 / 0,61,29-1 = 376,89 К
Термодинамическая работа
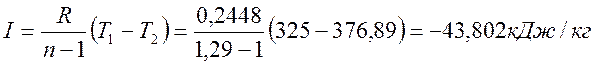
Изменение внутренней энергии
ΔU=CVCM · (Т2- Т1)= 0,84 • (376,89-325) = 43,588 кДж/кг
Изменение энтальпии
Δi = Cpсм • (Т2 – Т1)= 1,085 • (376.89 - 325)= 56,3 кДж/кг
Теплота процесса
q = 0 Дж/кг
Изменение энтропии
ΔS= 0 Дж/(кг-К)
Коэффициент распределения энергии
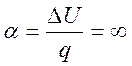
Потенциальная работа
IП= I · n = -43,802·1,29 = -56,505 кДж/кг
Относительная ошибка
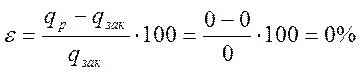
При n6 = 1,55 процесс является политропным
Конечное давление
P2 = P1 / εn =1,1·105/ 0,61,55 = 2,428·105 Па
Конечная температура
Т2 = Т1 / εn-1 = 325 / 0,61,55-1 = 430,43 К
Термодинамическая работа
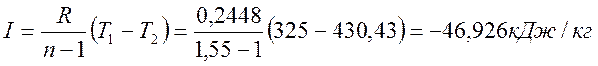
Изменение внутренней энергии
ΔU=CVCM · (Т2- Т1)= 0,84 • (430,43-325) = 88,561 кДж/кг
Изменение энтальпии
Δi = Cpсм • (Т2 – Т1)= 1,085 • (430,43 - 325)= 114,392 кДж/кг
Теплота процесса
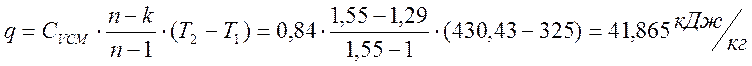
Изменение энтропии
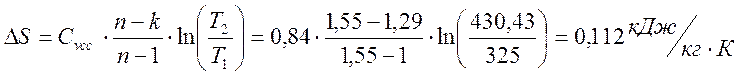
Коэффициент распределения энергии
α = ΔU/ q = 88,561 / 41,865 = 2,115
Потенциальная работа
IП= I · n = -46,926·1,55 = -72,735 кДж/кг
По первому закону термодинамики
q=I +ΔU= -46,926 + 88,561 = 41,635 кДж/кг
Относительная ошибка
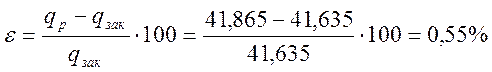
Сводная таблица результатов термодинамического расчета
|
Показатель политропы |
Р1 |
P2 |
V1 |
V2 |
Т1 |
Т2 |
ΔU |
Δi |
ΔS |
I1-2 |
IП |
q |
α |
ε |
|
105 Па |
м / кг |
К |
кДж/кг |
|||||||||||
|
0 |
1,1 |
1,1 |
0,723 |
0,434 |
325 |
195 |
-109,2 |
-141,05 |
-0,554 |
-31,824 |
0 |
-141,05 |
0,774 |
0,018 |
|
0,2 |
1,1 |
1,22 |
0,723 |
0,434 |
325 |
216 |
-91,577 |
-118,287 |
-0,468 |
-33,36 |
-6,672 |
-124,773 |
0,734 |
0,13 |
|
1 |
1,1 |
1,83 |
0,723 |
0,434 |
325 |
325 |
0 |
0 |
-0,125 |
-40,64 |
-40,64 |
-40,64 |
0 |
0 |
|
1,15 |
1,1 |
1,98 |
0,723 |
0,434 |
325 |
350,9 |
21,739 |
28,08 |
-0,06 |
-42,236 |
-48,571 |
-20,29 |
1,071 |
1,01 |
|
1,29 |
1,1 |
2,13 |
0,723 |
0,434 |
325 |
376,9 |
43,588 |
56,3 |
0 |
-43,802 |
-56,505 |
0 |
- |
0 |
|
1,55 |
1,1 |
2,43 |
0,723 |
0,434 |
325 |
430,4 |
88,561 |
114,392 |
0,112 |
-46,926 |
-72,735 |
41,635 |
2,115 |
0,55 |
Вывод
В процессе термодинамического расчета были получены параметры смеси идеального газа в различных состояниях для политропных процессов, в частности для изобарного, изотермического и адиабатного. С увеличением показателя политропы конечные параметры состояния и величины увеличиваются, а относительная ошибка расчета не превышает 1%.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.