




Анализ литературы по дегидратации этанола.
1.Было показано, что в процессе дегидратации этанола, на поверхности γ-Al2O3 формируются три промежуточных соединения:
Была предложена следующая модель реакции, согласующаяся с экспериментальными данными, точная физическая природы центров еще не установлена, S1 – может быть связана с кислотными центрами, а S2 – с основными.
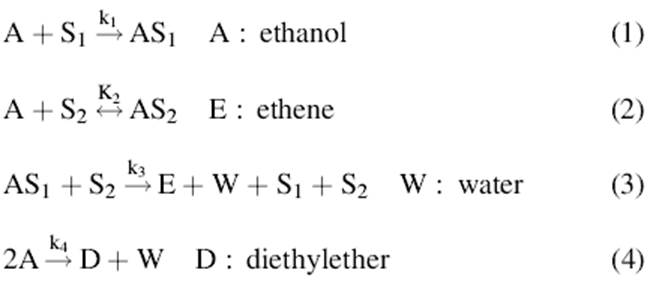
2.СЕПИОЛИТ; Диэтиловый эфир и этилен, оба являются первичными продуктами и формируются по следующей схеме:
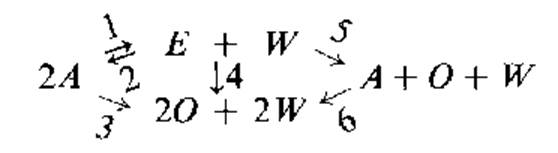
Где А- спирт, Е – эфир, O- олефин, W – вода
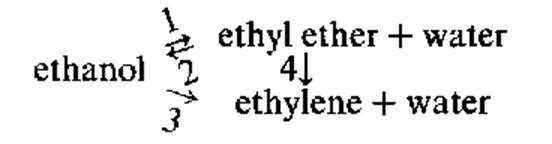
Было показано, что:
1.Скорость реакции увеличивается, при увеличении давления этанола
Выводы:
Сепиолит в котором часть ионов Mg2+ , находящихся в октаэдрическом окружении, замещено ионами Al3+, содержит средние и сильные Бренстэдовские центры, и является довольно активным в реакции дегидратации этанола. Соотношение продуктов и селективность в этой реакции такое же, как у алюмосиликатных и цеолитных катализаторов. Образование этилена и диэтилового эфира на Al-сепиолитах идет по схеме, показаной выше. Авторами было установлено, что вода, образующаяся в процессе дегидратации не влияет на скорость реакции. Образование этилена соответствует кинетической модели, в которой скорость лимитирующей, является стадия сорбции молекулы этанола на бренстодовском кислотном центре, в то время, как образование диэтилового эфира лучще всего объясняется моделью, в которой лимитирующей является стадия химического взаимодействия одной молекулы этанола, адсорбированной на бренстодовском кислотном центре и одной молекулы этанола из газовой фазы.
3.Переходные оксидные катализаторы; (Fe2O3, Mn2O3)
Введение
Этилен является важным сырьем для нефтехимической промышленности. Каталитическая дегидратация этанола в этилен была исследована, использую различные оксидные катализаторы, переходных металлов, такие как оксид титана, марганца, кобальта, хрома, серебряную соль фосфорновольфрамовой кислоты, Fe2O3/Al2O3, FeOx/Al2O3, Fe2O3, CoO, и NiO/глина, iron ion-exchanged mordenite и and Na2O-doped Mn2O3/Al2O3. Также дегидратация этанола была изучена, используя оксид алюминия и/или оксид кремния.
Экспериментальная часть
Приготовление образцов
Оксид железа Fe2O3 был получен методом осаждения нитрата железа(III) с последующим прокаливанием при температуре 500оС в токе очищенного воздуха в течение 5 часов.
Оксид марганца MnO2 был получен методом осаждения нитрата марганцы с последующем прокаливанием при темпертуре 700оС.
Смешанные катализаторы были получены при помощи физического смешения гидроксидов железа, марганца, алюминия и кремния в различных соотношениях с последующим прокаливанием при 700оС.
!!! Каталитическая активность образцов изучалась в реакторе с неподвижном слое при атмосферном давлении. Все эксперименты проводились в интервале температур 200-500оС.
Каталитическая дегидратация этанола
Экспериментльные данные для каталитической активности различных катализаторов в реакции дегидратации этанола показаны в таблице и рисунках 5-7. Из полученных экспериментальных данных ясно, что, для всех катализаторов, полная конверсия этанола увеличивается с увеличением температуры проведения процесса от 200 до 500С. Этилен и диэтиловый эфир являются основными продуктами. Наблюдались примеси ацетальдегида и этана. Выход продутов дегидратации от 19,2 до 71,2% для Fe2O3. УОксид марганца MnO2 он увеличивается только до 55,1% при температуре 500оС. С другой стороны, оптимум температура для реакции дегидратации этанола сдвигается до 400оС при использование катализатора с эквимолярным соотношением оксида марганца и железа. Кроме того доля продуктов дегидратации при этой температуре возрастает до 66.7%. При использовании следующего катализатора - 45-45-10 Fe2O3- MnO2- Al2O3 ,доля продуктов дегидратации постепенно возрастает от 20,5 до 59,7% при возрастании температуры реакции от 200 до 450 оС.
После использовании пятого катализатора (45-45-10 Fe2O3- MnO2-SiO2) Экспериментальные дынные показали высокою каталитическую активность, которая непрерывным увеличивалась с увеличением температуры в отличие от других катализаторов, где величина конверсии увеличивалась от 30,0 до 71,4%. При использовании кат6 (53-31-6-10 Fe2O3- MnO2- Al2O3- SiO2) доля продуктов дегидратации линейно возрастала при увеличении температуры от 200 до 450оС и достигала максимума 68,7% при температуре 500оС. Предварительные результаты были строго подтверждены данными по кислотности образцов. Из которых следует, что активность в реакции дегидратации возрастает с увеличением силы и количества кислотных центров.
Fe2O3.- селективность возрастает от 3,8-65,4% по этилену (200-500 оС)
MnO2 – более низкая селективность
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.