Розглянемо оборотну реакцію НА Û Н+ + А-. Запишемо константу рівноваги
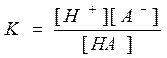 |
Константа рівноваги реакції іонізації називається константою іонізації (дисоціації. Константи дисоціації слабких кислот називають також константами кислотності (Кк), їхні значення для стандартних умов можна знайти в довіднику. Чим менше значення константи іонізації, тим слабкіше електроліт. Електроліти, що мають константи дисоціації менше 10-4, відносять до слабких електролітів, наприклад, для оцтової кислоти Кк = 1,74.10-5, для синильної кислоти HCN Кк = 4,79.10-10 (дуже слабка кислота).
Залежність К, a,і для бінарного електроліту (закон розведення Оствальду).
Розглянемо процес дисоціації слабкого бінарного електроліту (молекула розпадається на два іони) у загальному виді (a - ступінь дисоціації слабкого електроліту):
АВ Û А+ + В-
С - -
aС aС aС де, aС- концент. молекул, що розпалися на іони та утворених іонів,
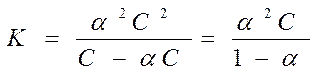 |
Для дуже слабких електролітів a®0 і тоді К@a2С - закон розведення Освальда для бінарного електроліту. Розведення розчину слабкого електроліту супроводжується збільшенням ступеня дисоціації.
Отже концентрація відповідного іона в розчині слабкого електроліту буде дорівнювати добутку загальної концентрації речовини на ступінь дисоціації a.: К@a2С , де К – константа дисоціації слабкого електроліту. Виходячи з закону розведення :
[H+]=ÖK× CM, pH = -lg(K×CM)1/2, pH= ½ ×(pK- lgCM). (7)
Особливості розчинів сильних електролітів.
Властивості, що виявляють розчини сильних електролітів, не відповідають дійсній концентрації іонів у розчині. Ізотонічний коефіцієнт, розрахований з дослідних даних, не є цілим числом (2,3,4 і т.д.), ступінь дисоціації, визначена експериментально, виявляється менше 100% (хоча молекул, що не розпалися, немає).
ПРИКЛАД 1. Розглянемо сіль NaCl. У кристалі соли знаходяться тільки іони, що під
впливом молекул води переходять у розчин (іон-дипольна взаємодія):
Nan+ Cln- + n (x + y) H2O ¾¾® nNa+ × x H2O + nCl- × y2O
кристал гідратовані іони
Процес дисоціації необоротний. Молекул немає ні в кристалах, ні в розчині. Виходить, теоретично i = 2, a =1. Експериментально встановлено, що розчин солі з моляльною концентрацією сm = 0,1 (моль/кг води) має температуру замерзання мінус 0,336 0С. Таким чином, DТзам = 0,336 градусів. За законом Рауля DТзам = i Kcm. Тоді, i = 0,336/(1,86×0,1) = 1,8.
a = (i – 1)/(k – 1) = (1,8-1)/(2-1) = 0,8 (чи 80%) – уявна ступінь іонізації.
ПРИКЛАД 2 Визначити рН розчинів:
. 1) Розчин 0,1 моль/л NaOH – це сильний електроліт, дисоціює повністю,
[OH-] = 0,1 моль/л, [H+] = КВ / [OH-] = 1×10-14/0,1 = 1×10-13 моль/л, рН = 13, лужний розчин.
2) Розчин 0,001 моль/л НС1 – це сильна кислота, дисоціює повністю,
[H+] = 0,001 моль/л, рН = 3, кислотний розчин.
ПРИКЛАД 3. Визначити активність іонів водню в розчині 0,05н соляної кислоти та рН розчину.
1) Визначимо молярну концентрацію 0,05 н розчину соляної кислоти. Так як соляна кислота – одноосновна – отже См=СN =0,05 моль/л
2) Іонна сила розчину дорівнює І = 0,5(С(Н+)×1 + С (Cl-)×1)= 0,5 ×( 0, 05+0,05)= 0,05
3) Коефіцієнт активності знайдемо за формулою lg f= -0,5z2ÖI = -0,112; f= 0,95
4) Активність а = fCM= 0,95×0,05=0,0475 моль/л
5) рН = -lg 0,0475=1,3
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.