Використання для визначення дзета-потенціалу часток у суспензії електрофорезу, як прийнято у випадку ліозолей, утруднене тим, що великі частки суспензій будуть не стільки пересуватися до електрода, скільки осідати під дією сили ваги.
Однак у суспензіях проявляються всі чотири види електрокінетичних явищ, спостережуваних у ліофобних золях: електрофорез, електроосмос, потенціал плину, потенціал седиментації.
Більше того, явище електрофорезу було вперше описане професором Московського університету в 1809 році Рейссом саме на прикладі суспензії глини, а явище електроосмосу - на прикладі суспензії кварцу, де була діафрагма із кварцового піску.
Седиментаційна стійкість суспензії — це здатність її зберігати незмінним у часі розподіл часток по об'єму системи, тобто здатність системи протистояти дії сили ваги.
Так як більшість суспензій виявляються полідисперсними системами, що містять і відносно великі частки, які не можуть брати участь у броунівському русі, суспензії є седиментаційно (кінетично) нестійкими системами. Якщо щільність часток менше щільності дисперсійного середовища, то вони спливають, а якщо більше - осідають.
• В агрегативно стійких суспензіях осідання часток відбувається повільно й формується дуже щільний осад. Порозумівається це тим, що поверхневі шари перешкоджають агрегуванню часток; сковзаючи друг по другу, частки можуть перейти в положення з мінімальної потенційною енергією, тобто з утворенням упакування, близької до щільної.
Агрегативна стійкість суспензії— це здатність зберігати незмінної в часі ступінь дисперсності, тобто розміри часток й їхня індивідуальність.
Агрегативна стійкість розведених суспензій досить подібна з агрегативною стійкістю ліофобних золів. Але суспензії є більше агрегативно стійкими системами, тому що містять більші частки й, отже, мають меншу вільну поверхневу енергію.
При порушенні агрегативной стійкості суспензії відбувається коагуляція — злипання часток дисперсної фази. Коагуляція - це мимовільний процес, тому що супроводжується зменшенням вільної енергії системи за рахунок зменшення межфазной поверхні. Цей процес аналогічний тому, що відбувається в лиозолях, більше того, коагуляція лиозолей приводить до утворення суспензій і далі може тривати в них, приводячи до утворення осаду. Цей осад часто є концентрованою суспензією (пастою) - тобто структурованою системою.
Для досягнення агрегативної стійкості суспензії необхідне виконання принаймні одного із двох умов:
• змочування поверхні часток дисперсної фази дисперсійним середовищем;
• наявність стабілізатора.
Перша умова. Якщо частки суспензії добре змочуються дисперсійним середовищем, то на їхній поверхні утвориться сольватна оболонка, що володіє пружними властивостями й перешкоджає сполукою часток у великі агрегати. Гарна змочуванність часток спостерігається в суспензіях полярних часток у полярних рідинах і неполярних частках у неполярних рідинах.
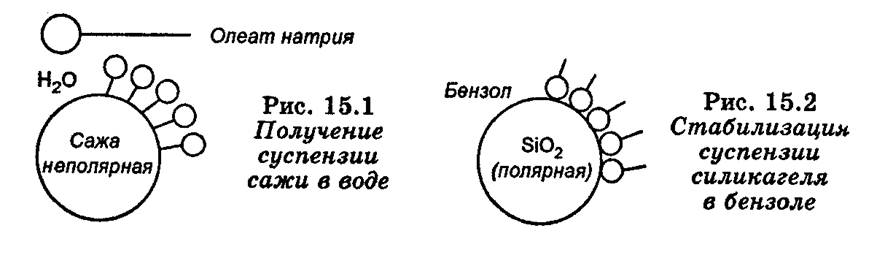
Прикладом агрегативно стійких суспензій без стабілізатора і є суспензії кварцу у воді й сажі в бензолі. Тому що кварц добре змочується водою, а сажа - бензолом, ці суспензії агрегативно стійкі без третього компонента - стабілізатора. Якщо замінити дисперсійне середовище, (наприклад, розмішати порошок сажі у воді), то виходить агрегативно нестійка система - частки сажі водою не змочуються, гідратна оболонка не утвориться й незахищені часточки легко з'єднуються один з одним.
Друга умова. Якщо частки суспензії не змочуються або погано змочуються дисперсійним середовищем, то використають стабілізатор.
Стабілізатор — це речовина, додавання якого в дисперсну систему підвищує її агрегативную стійкість, тобто перешкоджає злипанню часток.
 В
якості стабілізаторі в суспензій застосовують:
В
якості стабілізаторі в суспензій застосовують:
• низькомолекулярні електроліти;
• колоїдні ПАР. При використанні ПАР діє той самий механізм, що властиві ПАР. Колоїдні ПАР мають дифільну будову, і здатні адсорбуватися як на полярних так і на неполярних поверхнях.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.