Лекція 10.
Тема: ВИДИ КОЛОЇДНИХ СИСТЕМ
План.
1. ПАР – поверхнево-активні речовини. Властивості.. Використання
2. Суспензії. Класифікація. Властивості. Методи приготування та руйнування. Пасти.
3. Емульсії. Класифікація. Властивості. Методи приготування та руйнування. Емульгатори
4. Піни. Характеристика. Одержання. Руйнування. Практичне використання.
ПАР — це речовини, додавання яких у гетерогенну систему зменшує поверхневий натяг на границі роздягнула фаз. При цьому у всьому інтервалі концентрацій аж до насиченого розчину ПАР перебувають у молекулярно-дисперсному стані, тобто системи є гомогенними.
При подовженні вуглеводневого ланцюга до 8-10 атомів вуглецю виникає нова властивість — здатність молекул ПАР поєднуватися в агрегати, що містять десятки молекул і називані міцелами. При малих концентраціях ці ПАР утворять справжні розчини. При збільшенні концентрації розчину до певної величини, названою критичною концентрацією міцелоутворення (ККМ), у розчині поряд з молекулами ПАР присутні міцели, тобто з'являється нова фаза. Такі системи характеризуються двома властивостями: високою дисперсністю й гетерогенністю, тобто мають властивості колоїдних розчинів.
Колоїдні ПАР — це речовини, які не тільки знижують поверхневий натяг на границі розділу фаз, але при певних концентраціях здатні до мимовільного міцелоутворення, тобто до утворення нової фази.
Відмінність колоїдних ПАР від звичайних полягає тільки в довжині вуглеводневого радикала.
ВЛАСТИВОСТІ ВОДЯНИХ РОЗЧИНІВ ПАР
Відзначимо три основних властивості водяних розчинів ПАР
1. Здатність значно знижувати поверхневий натяг на границі розділу фаз.
2. Здатність до мимовільного міцелоутворення.
3. Солюбилізація.
ЗДАТНІСТЬ ПАР ЗНИЖУВАТИ ПОВЕРХНЕВИЙ НАТЯГ НА ГРАНИЦІ РОЗДІЛУ ФАЗ
залежить, головним чином, від довжини вуглеводневого радикалу; з його збільшенням поверхнева активність зростає. Правило Дюкло-Траубе говорить: збільшення довжини вуглеводневого радикалу на одну групу —СН2— приводить до зростання поверхневої активності в 3-3,5 рази
Поверхнева активність ПАР (g) безпосередньо визначає адсорбційну здатність ПАР: чим вона більше, тим більше адсорбційна здатність. Адсорбуючись на частках дисперсної фази, молекули ПАР створюють на їхній поверхні адсорбційно-сольватні захисні оболонки, які через відповідну орієнтацію молекул ПАР («хвостом» або «голівкою») значно знижують поверхневий натяг і перешкоджають злипанню або злиттю часток
Миюча дія колоїдних ПАР засновано на сукупності колоїдно-хімічних процесів.
1. У присутності ПАР внаслідок зменшення поверхневого натягу поліпшується змочування твердої поверхні, рідина краще проникає в тонкі капіляри тканини.
2. Молекули мила, адсорбуючись на поверхні волокна й частках твердих або рідких забруднень, створюють адсорбційний шар, що обумовлює виникнення тиску. Це сприяє відриву часток і переходу в миючу рідину.
3. Адсорбційні плівки на поверхні часток забруднень надають цим часткам високу агрегативну стійкість і попереджають їх прилипанню до поверхні волокна в іншому місці.
4. У присутності колоїдних ПАР в розчині утвориться піна, що сприяє механічному віднесенню часток забруднень від поверхні.
5. Масляні забруднення втримуються у водному середовищі внаслідок солюбилизации, про яку мова йтиме далі.
Критична концентрація міцело утворення ККМ лежить звичайно в межах 10-3-10-6 моль/дм3. Після досягнення цієї концентрації в розчині мимовільно утворяться сферичні міцели (міцели Гартли) і система стає гетерогенною. Стан колоїдного ПАР після досягнення ККМ можна записати так (без гідролізу солі):
«RCOONa -» nRCOCT + nNa+ <-> (RCOO~)п + nNa+
Справжній розчин Ліофільний колоїдний
розчин
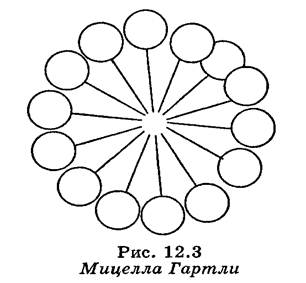
Міцела ліофільного золю — це ассоціат дифільних молекул, ліофільні групи яких звернені до розчинника, а ліофобні групи з'єднуються один з одним, утворюючі ядро.
На мал. схематично зображена міцела Гартли. Така орієнтація дифільних молекул в міцелі забезпечує мінімальний поверхневий натяг на границі «міцела - дисперсійне середовище».
Виникає питання — чому утворення міцел відбувається мимовільно, адже відомо, що утворення нової фази завжди вимагає витрати енергії. Оскільки поверхневий натяг на границі з дисперсійним
середовищем мінімальний, енергія, утворення міцели, невелика. Ця енергія компенсується виграшем енергії за рахунок виведення вуглеводневих хвостів молекул ПАР в ядро міцели ,що, по суті справи, являє собою рідкий вуглеводень утворений в результаті щільній упаковці вуглеводневих ланцюгів. Цей виграш становить 1,08 kТ (k — постійна Больцмана, Т — температура), тобто при Т = 298 С величину, рівну 2,6 кДж на кожну -СН2-групу. Таким чином, міцелоутворення супроводжується зменшенням вільної енергії системи.
Діаметр міцели Гартли дорівнює подвоєній довжині молекули ПАР.
Число молекул ПАР, що становлять міцелу, називається числом асоціації п. Це число швидко росте у вузькому інтервалі концентрацій ПАР звичайно від 20 до 100 (іноді й більше).
Для іоногених ПАР n збільшується при зниженні температури й додаванні електролітів.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.