Розглянемо окремо взяті молекули рідини в середніх шарах і на поверхні поділу двох фаз рідина/ повітря.
У внутрішніх шарах рідини на молекулу з усіх боків діють сили при тяжінні і відштовхування і в кінці кінців всі ці сили зрівноважені, а рівнодіюча всіх сил =0.
На поверхні молекули зазнають лише при тяжіння внутрішніх шарів, отже молекули поверхневих шарів не зрівноважені і мають надлишкову енергію , а рівнодіюча всіх сил ≠0, і направлена в середину і система намагається втягнути поверхневі молекули в середину. Саме це пояснює шароподібність краплин. Тому середня енергія молекул поверхневих шарів і молекул в середині фази відрізняються.
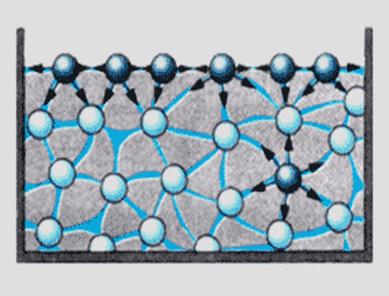
Тому важливою характеристикою молекул поверхневих шарів є поверхнева енергія – Gs – різниця між середньою енергією молекул на поверхні і молекул в об’ємі фази помножена на кількість молекул.
Як відомо з термодинаміки будь-яка система намагається зменшити свою надлишкову енергію. Зрозуміло, що чим менша буде сама поверхня, тим менше буде поверхневих молекул, а значить менша надлишкова енергія. Виходячи з формули Gs = S×s, зрозуміло, що зменшення енергії F буде пов’язано із зменшенням площі поверхні S а також s - поверхневого натягу.
Висновок: термодинамічно вигідний процес – зменшення надлишкової енергії залежить від S і s Зменшення хоч би одного з показників приведе до зменшення надлишкової енергії, що є вигідним для системи.
Як відомо з термодинаміки будь-яка система намагається зменшити свою надлишкову енергію. Як можна зменшити надлишкову енергію?
Зрозуміло, що чим менша буде сама поверхня, тим менше буде поверхневих молекул, а значить менша надлишкова енергія. Виходячи з формули G= Ss, зрозуміло, що зменшення енергії G буде пов’язано із зменшенням площі поверхні S а також s - поверхневого натягу.
Поверхневий натяг s — фізичне явище, суть якого в прагненні рідини скоротити площу своєї поверхні при незмінному об'ємі. Його можна розглядати з двох точок зору: як силу і як поверхневу енергію.
Поверхневий натяг s - Визначають як силу, прикладену до одиниці довжини поверхні поділу фаз і направлена на її скорочення (Н/м).
Поверхневий
натяг, пов’язаний із енергією Гіббса і визначає максимально корисну роботу при
збільшенні площі поверхні поділу фаз питома енергія поверхні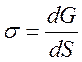 (Дж/м2)
(Дж/м2)
Поверхневий натяг буде позитивний якщо молекули поверхневих шарів взаємодіють з молекулами цієї фази сильніше ніж з молекулами іншої фази. І навпаки.
Відповідно принципу мінімуму енергії будь яка система намагається зменшити свою надлишкову енергію і якщо s>0, фаза намагається зменшити свою поверхню – скоротити. Влив поверхневих шарів на загальні властивості визначається кількістю частинок, що є на поверхні, тобто питомою поверхнею S/V (поверхня, що припадає на одиницю об’єму.). Тоді вільна енергія буде складатися з поверхневої і об’ємної енергій
![]()
Поділив вираз на об’єм фази маємо :
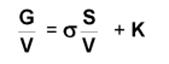
При вивченні гомогенних систем, зрозуміло, що вклад поверхневої енергії незначний. При вивченні систем з розвинутою поверхнею поділу фаз поверхнева енергія має вирішальне значення.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.