Лекція № 1
Тема : Предмет вивчення колоїдної хімії
Поверхневі явища. Адсорбція.
Колоїдна хімія - це наука о властивостях, одержанні та застосуванні гетерогенних високодисперсних систем. До гетерогенних систем належать такі, в яких один або більше компонентів – так звана дисперсійна фаза – подрібнені в певному середовищі – дисперсійному середовищі.
Мірою роздробленості всякої дисперсної системи може бути або поперечний розмір часток "а" (для сферичних частинок - діаметр "d", а для частинок, що мають форму куба - ребро куба "l"), або зворотня йому величина D = 1 / а, так звана дисперсність, або питома поверхня Sпит, тобто міжфазна поверхня, яка припадає на одиницю обєма дисперсної фази. Всі ці величини взаємозалежні. Чим менше розмір часток, тим більше дисперсність або питома поверхня, і навпаки.
Для системи з сферичними частинками дисперсної фази питома поверхня визначається по формулі:
![]()
Або в загальному вигляді:
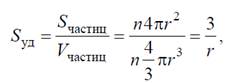
Sпит = Sчастинок / Vчастинок = 6 D., де D – дисперсність.
Верхня межа дисперсності колоїдних систем обумовлена тим, що при подальшому дробленні речовини в розчині вже будуть знаходиться не агрегати молекул, а окремі молекули, що мають розмір порядка 0,1 нм. Нижня межа дисперсності колоїдних систем визначається різким зниженням інтенсивности теплового руху частинок з поперечним розміром більше 100 нм.
Класифікація дисперсних систем за ступенем дисперсності
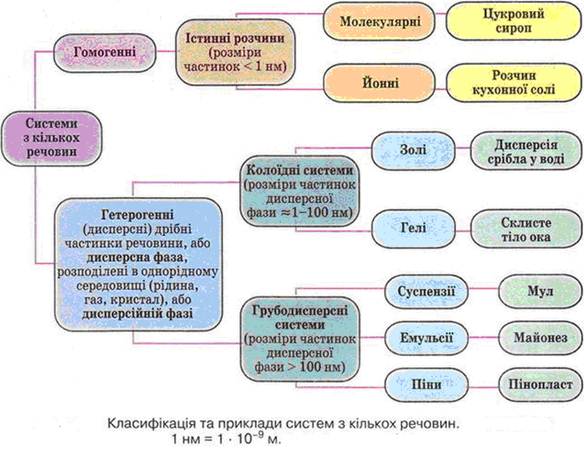
Класифікація колоїдних систем за агрегатним станом
|
Дисперсна фаза |
||||
|
Дисперсійне середовище |
Газ |
Рідина |
Тверда |
|
|
Газ |
Туман Аерозоль |
Дим смог |
||
|
рідина |
Піни |
Емульсії (молоко) золі |
Суспензії (мул) золі |
|
|
тверде |
Тверда піна (пемза) |
Тверда емульсія Гель (желе) |
Сплави металів Твердий золь (рубін, сапфір) |
|
Властивості грубо- і високодисперсних систем багато в чому відрізняються, але наявність границі розділу фаз і роздробленість однієї з них, тобто дисперсність і гетерогенність, - то спільне, що об'єднує ці системи.
Класифікація по міжфазній взаємодії
Взаємодія між речовинами дисперсної фази і дисперсного середовища за рахунок міжмолекулярних сил на межі розділу фаз протікає завжди, але ступінь її прояву може бути різним. У залежності від цього дисперсні системи можуть бути ліофільним і ліофобними. Для перших характерна сильна міжмолекулярна взаємодія речовини дисперсної фази з середовищем, а для других - слабка. Ліофільні системи термодинамічно стійкі (Δ G ≤ 0) і характеризуються самодовільним диспергуванням. Системи, в яких самовільного диспергування не відбувається, можуть бути названі ліофобні, але ліофілізовані в тій чи іншій мірі.
Способи одержання дисперсних систем
Для одержання дисперсних систем використовують найрізноманітніші методи, але всі вони зводяться або до подрібнення великих шматків речовини до необхідної дисперсності, або до об'єднання молекул або іонів в агрегати з розмірами дисперсної фази. Відповідно до цього існують методи отримання систем:
1) диспергування;
2) конденсації.
Діспергаційні методи одержання дисперсних систем
1. Механічне диспергування. Ці методи засновані на механічних способах подолання міжмолекулярних сил. Накопичення вільної енергії в процесі диспергування відбувається за рахунок зовнішньої механічної роботи. ΔF>> 0 Диспергуванням називають подрібнення твердих або рідких тіл в інертному середовищі. При цьому сильно збільшується дисперсність речовини і утворюється дисперсна система, що володіє питомою поверхнею.
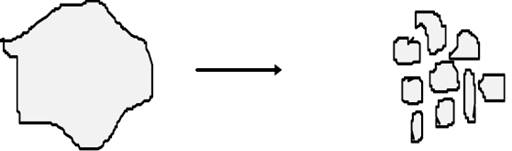
До пристроїв, що подрібнюють відносяться кульові, стержневі, колоїдні млни, вальці,
Конденсаційні методи
Утворення колоїдних систем за конденсаційним механізмом можливо, якщо, з одного боку, виникає велике число зародків нової, термодинамічно більш стабільної фази, з іншого боку, швидкість росту цих зародків лежить в області визначених (помірних) значень. Фактори, які призводять до появи метастабільності вихідної системи, поділяються на дві групи: хімічні, тобто протікання хімічних реакції, що призводять до виникнення високих концентрації слаборозчинних сполук, і фізичні, такі як зміни тиску, температури.
Будь-яка хімічна реакція, що приводить до утворення нерозчинного, а в разі конденсованих фаз, і летючого продукту (або, навпаки, нелетючого - при взаємодії газів), може бути використана для отримання колоїдної системи. Для утворення золів наводять різні хімічні реакції:
- Окислення-відновлення,
- Обміну, - Гідролізу та ін.
Заміна розчинника.
Метод заснований на зміні складу середовища таким чином, що хімічний потенціал компонента в дисперсійному середовищі стає вище рівноважного і тенденція до переходу в рівноважний стан призводить до утворення нової фази. Так може бути отриманий золь каніфолі. Якщо насичений розчин каніфолі в етіловом спирті влити в великий об'єм води, то отриманий розчин в спиртоводному середовищі буде пересиченим. Пересичення призводить до агрегації частинок каніфолі, система стає гетерогенною, утворюється колоїдна система - золь каніфолі. Таким чином, можуть бути отримані гідрозолі сірки, фосфору, миш'яку, багатьох органических речовин.
Поверхнева енергія колоїдних систем
Властивості гетерогенних систем в більшій мірі залежать того, що всі гетерогенні системи мають поверхню поділу фаз. Властивості частинок поверхневих шарів значно відрізняються від тих частинок, що містяться в об’ємі фази. Процеси, що відбуваються на поверхні поділу фаз, називаються поверхневими. До поверхневих явищ відносяться адсорбція, змочування, розтікання однієї рідини по поверхні іншої і т. і. Поверхневі явища надзвичайно широко поширені в природі. В організмі людини процеси дихання, засвоєння живильних речовин прямо пов'язані із процесами адсорбції. Відомо, наприклад, що загальна площа біологічних мембран в організмі людини становить десятки тисяч квадратних метрів. Навіть такі наші почуття як нюх, смак, залежать від адсорбції певних молекул у носовій порожнині й на язику.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.