

Лекція 4. Стійкість колоїдних систем. Коагуляція, старіння золів
План
1. Електрокінетичний потенціал .
2. Коагуляція колоїдів.
3. Поріг коагуляції.
4. Правило Шульца-Гарді
5. Пептизація колоїдних розчинів
Електрокінетичний потенціал.
Коли поверхня твердого тіла адсорбувала з розчину іони певного знака заряду, тверда поверхня набуває відповідного заряду. Іони протилежного знака заряду притягуються до твердої поверхні, внаслідок чого утворюється подвійний шар. Між твердою поверхнею, з одного боку, і рідиною з другого , виникає різниця потенціалів, яка називається термодинамічним потенціалом. Величина потенціалу визначається густиною заряду, яка залежить від адсорбції іонів твердою поверхнею. При направленому русі рідини відносно твердого тіла дуже близько від поверхні його зберігається шар рідини, нерухомий щодо твердого тіла. Таким чином, ковзання рідкої фази відносно твердої відбувається не безпосередньо біля твердої поверхні, а самій рідині, віддаленій від твердої фази на певну відстань, яка має молекулярні розміри. Частина протиіонів залишається в нерухомому шарі рідини, частина в рухомому.
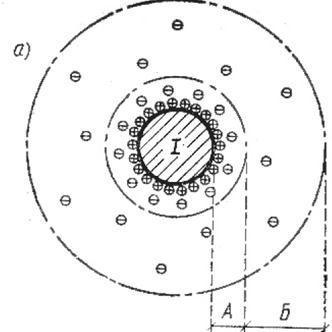
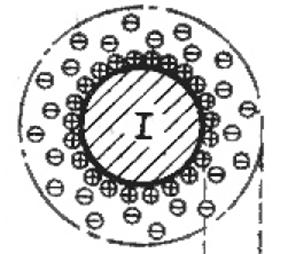
Електрокінетичний потенціал x – це різниця потенціалів між твердою поверхнею і шаром рідини, нерухомо зв’язаним з нею з одного боку , і рештою рідини, яка переміщується відносно твердого тіла
Колоїдна часточка безперервно рухається. Разом з нею рухається також адсорбційний шар рідини, нерухомо зв’язаний з нею. Колоїдна часточка заряджена завдяки вибірковій адсорбції іонів з розчину. В адсорбційному шарі є певний надлишок протиіонів. Сумарний заряд цієї рухомої системи, від якого безпосередньо залежить сила відштовхування складається з алгебраїчної суми заряду твердої колоїдної часточки, яка називається ядром і заряду протиіонів, що містяться в адсорбційному шарі рідини. Густина сумарного заряду, власне кажучи, і визначає величину електрокінетичного потенціалу. Отже величина електрокінетичного потенціалу визначає також сили відштовхування , а отже і агрегативну стійкість колоїдного розчину.
Достатня стійкість колоїдного розчину забезпечується при величині електрокінетичного потенціалу x = 0,07В, при значеннях менших x = 0,03В сили відштовхування надто слабі, щоб протистояти агрегації, а тому відбувається коагуляція, яка неминуче закінчується седиментацією.
Величину електрокінетичного потенціалу можна визначити за допомогою приладу для електрофорезу за формулою:
phul
x = ---------
ED
Де: h - в’язкість ;u - швидкість переміщення частинок ;l – відстань між електродами вздовж розчину; Е – електрорушійна сила ;D – діелектрична стала.
Фактори, що впливають на x-потенціал.
1. Наявність в розчині індиферентного електроліту – електроліту , що не містить потенціалвизначаємий іон.
- індиферентний електроліт містить протиіон. В такому випадку відбувається стиснення дифузійного шару і падіння x і як наслідок – коагуляція.
- індиферентний електроліт містить іон однознаковий з проти іоном, але не сам протиіон. В такому випадку відбувається іонний обмін: протиіон заміщується на іони індиферентного електроліту. Спостерігається падіння x, але ступінь падіння буде залежити від природи іону –замісника, його валентності, ступеня гідратованості. Ліотропні ряди катіонів та аніонів по їх здатності стикати дифузійний шар і викликати падіння x-потенціалу.
Li-Na-NH4-K-Rb-Cs-Mg-Ca-Ba CH3COO--F- -NO3- - Cl- -I- -Br- -SCN—OH—SO42—
2. Додавання до розчину електроліту – стабілізатора- електроліту, що містить потенціалвизначаємий іон викликає збільшення x-потенціалу , а значить сприяє стійкості колоїдної системи, але до певної межі.
2. Коагуляція колоїдів.
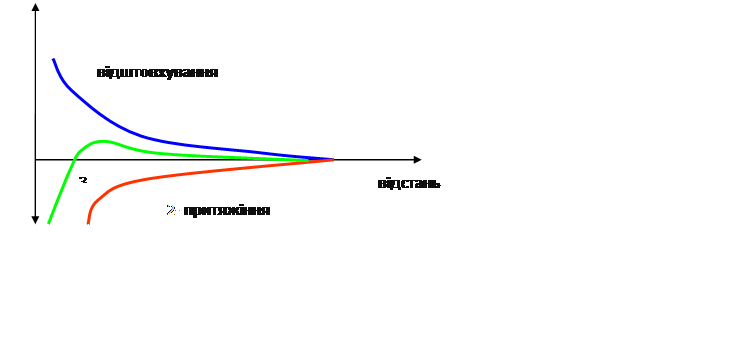
Сучасна теорія стійкості та коагуляції колоїдних систем створена Дерягіним , Ландау, Фервеем, Овербеком одержала назву теорії ДЛФО. Згідно цієї теорії стійкість дисперсної системи визначається балансом сил притяжіння та відштовхування , що виникають між частинками при їх зближенні внаслідок броунівського руху. Згідно Н.П. Пескову (1922 р.) розрізняють кінетичну та агрегативну стійкість колоїдних систем.
Між молекулами діють сили притяжіння – Ван-дер-Ваальсові сили. Діють навідстані 400 А.
Сили відштовхування залежать від x потенціалу. Вони зростають при зближені колоїдних частинок, коли їх іонні атмосфе6ри перекриваються
 |
Під коагуляцією розуміють збільшення колоїдних частинок в результаті їх злиття.
Коагуляція колоїдів відбувається під впливом різних факторів, які зменшують електрокінетичний потенціал і тим самим сприяють агрегації колоїдних частинок. Для початку коагуляції треба, щоб 3. концентрація електроліту була вищою за певну мінімальну величину с, яка називається порогом коагуляції. Якщо концентрація електроліту буде меншою с, коагуляція не відбудеться. При всіх вищих значеннях с коагуляція відбудеться, причому швидкість її буде тим більшою, чим більша концентрація електроліту.
4. Іони, що спричиняють коагуляцію завжди несуть заряд , протилежний заряду колоїдної частини. Чим вищий заряд іонів, що спричиняють коагуляцію, тобто чим вища їх валентність, тим при меншій їх концентрації почнеться коагуляція. Вказану залежність називають правилом Шульце-Гарді:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.