



Лекція 6. Високомолекулярні сполуки
План
1. Властивості високомолекулярних полімерів.
2. Високомолекулярні електроліти - білки.
3. Ізоелектрична крапка білку.
1. Високомолекулярними називаються речовини (ВМС), молекулярна маса яких сягає від 100000 до декількох мільйонів
Температура кипіння таких речовин вище ніж температура їх розкладання , тому вони існують як правило в рідкому чи твердому стані.
Розрізняють природні ВМС (неорганічні : алмаз, глини, слюда; органічні - білки, поліцукри, вовна) та штучні (різні волокна, тканини, пластмаси та ін).
Методи одержання штучних ВМС основані на таких типах реакцій:
- полімеризації – сполучення молекул мономерів з утворенням макромолекул, що по елементному складу не відрізняються від мономеру :n (СН2=СН2)à(-CH2-CH2-)n
- -поліконденсації – сполучення мономерів, що упроводжується виділенням води або іншої низькомолекулярної сполуки (Наприклад утворення нейлону )
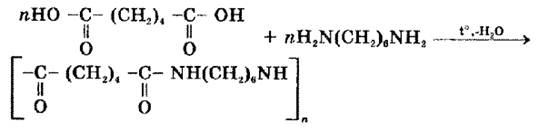
- сополімеризація – сполучення двох і більше мономерів різного складу
Ступенем полімеризації – n- називають число, що показує скільки разів повторюються ланцюги в макромолекулі.
По будові макромолекул ВМС виділяють :
- Лінійні полімери (поліетилен) вони мють високі еластичі властивості, здатні розчинятися. Утворюють нитки, волокна.
- Просторові полімери утворюються , коли мономери, що утворюють полімер мають більше двох функціональних груп. Вони менш еластичні, мають більшу твердість , менш розчинні, але здатні до набухання – (фенол формальдегідні смоли)
- Розгалужені полімери – утворюються з мономерів, що мають більше двох функціональних груп. Їх властивості – середні між розглянутими першими двома групами – Приклад – крохмаль
Розрізняють ВМС – електроліти і неелектроліти
Властивості розчинів ВМС можна розглядати як властивості справжніх молекулярних розчинів і як властивості ліофобних золів.
З молекулярними розчинами їх поєднує :
- агрегативна стійкість
- активна взаємодія частинок ВМС з рідким середовищем
- гомогенність,
- відсутня поверхня поділу фаз, що робить систему нестійкою.
Одночасно існують властивості, що поєднують розчини ВМС з колоїдними розчинами:
- великі розміри молекул ВМС (відповідають розмірам міцел)
- не здатні проходити крізь мембрани (великі розміри молекул)
- не значна швидкість дифузії
При взаємодії ВМС з розчинником відбувається набрякання – процес збільшення об’єму та маси полімеру при контакті з розчинником. (збільшення в10-15 разів)
Кількісною мірою набрякання є ступінь набрякання - a
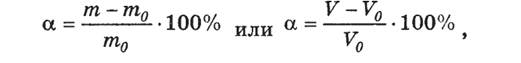
де m0 ,V0 – маса або об’єм сухого полімеру, m, V – маса та об’єм полімеру після набряку
Причина набрякання в різниці властивостей ВМС і розчинника. Молекули ВМС на декілька порядків по розмірам і по рухливості відрізняються від молекул розчинника. Тому перехід макромолекул у фазу розчинника відбувається дуже повільно, а молекули розчинника швидко проникають в сітку полімеру, розсовуючи його ланцюги і збільшують об’єм.
Але набрякання це не простий процес проникнення - це є міжмолекулярна взаємодія , наслідком якої є гідратації молекул. Тому процес набрякання дуже специфічний : полімер набрякає лише в тому випадку коли розчинник з яким контактує ВМС підходять дин одному по своїй природі– «подібне в подібному».
Обмеженість набрякання визначається співвідношенням між енергією решітки ВМС, енергії гідратації та ентропійного фактору.
Лінійні молекули набрякають при підвищених температурах в «добрих»розчинниках дуже сильно.
Просторові ВМС – набрякають обмежено, так як енергія на розсування решітки ВМС більша ніж виграш енергії гідратації.
Лінійний полімер – натуральний каучук – необмежено набрякає в бензолі, а вулканізований каучук (просторова структура) обмежено набрякає в бензолі. Введення в полімер полярних груп зменшує набрякання в неполярних розчинниках і збільшує в полярних.
Процес набрякання відбувається самовільно
![]()
На першій стадії – відбувається сольватація молекул виділяється енергія – набрякання незначне.
На другій стадії теплота не виділяється , але відбувається розсовування решітки ВМС – зростає ентропія системи – відбувається максимальний процес набрякання.
Набрякання може закінчитися повним розчиненням - необмежене набрякання.
Розчинення ВМС супроводжується зменшенням енергії Гіббса отже утворюються термодинамічна стійка система.
Однак слід сказати, що в розчинниках, які не відповідають природі ВМС молекули ВМС згортаються в клубок. При цьому виникає між фазна поверхня, система стає гетерогенною – не стійкою.
2. Високомолекулярні електроліти – ВМС здатні в розчинах дисоціювати з утворенням іонів.
В залежності від природи іонів ВМС поділяють:
- кислотні – що мають кислотні групи - -СОО-;
- основні – що мають групу –NH3+
- поліамфоліти - що мають як кислотні групи - -СОО- так і групу –NH3+. До останніх відносяться білки.
Структура білку :
- Молекули білків складаються з амінокислот, що мають кислотні та основні групи
![]()
де R – достатньо великий вуглеводневий радикал.
В кислому середовищі дисоціація карбоксильної групи практично не відбувається і білок веде себе як слабка основа:
![]()
Внаслідок розглянутої взаємодії білок набуває позитивного заряду, сили відштовхування сприяють розгорненню молекули в лінійну.
В лужному середовищі (NaOH) дисоціація групи NH3OH практично не відбувається і білок веде себе як слабка кислота
![]()
Молекула набуває негативного заряду і також намагається розгорнутися. Таким чином в лужному чи кислому середовищі молекула білку має певний заряд і лінійну структуру.
Підбираючи певне значення рН білкового розчину можна досягнути – ізоелектричного стану білку –
стан білкової молекули , при якому позитивні та негативні заряди взаємно компенсовані.
Молекулу білка в такому стані можна вважати нейтральною, хоча вона має певні функціональні групи. В цьому стані молекула білку згорнута в клубок або спіраль.
Ізоелектрична крапка білку – (ІКБ) це значення рН при якому білок переходе в ізоелектричний стан.
В більшості випадків білок є більш сильна кислота , тому ІКБ має значення рН <7. Отже для одержання ізоелектричного стану в розчині має бути незначний надлишок кислоти.
Як показують спостереження в ізоелектричному стані білковий розчин має найменшу в’язкість , що пов’язане із зміною форми макромолекул. В розгорнутому стані молекули білку займають більший об’єм і як наслідок розчин має більшу в’язкість.
На форму білка впливає не тільки середовище, але і введення в розчин індиферентного електроліту. Невеликі кількості електроліту знижують дисоціацію функціональних груп, і молекула лишається скрученою в клубок чи спіраль.
При великих концентраціях електроліту відбувається висолювання – зменшується розчинність білку, а макромолекули його утворюють щільні клубки. Дія іонів на білкові розчини відповідно ліотропного ряду катіонів та аніонів.
2.Термінологічний словник.
Високомолекулярні сполуки ВМС-
Набрякання
Ізоелектричний стан
Ізоелектрична крапка білку ІКБ
3. Рекомендована література
|
А.И.Болдырев. Физическая и коллоидная химия . «Высшая школа», М.: 1983г. |
|
Фролов Ю.Г. Курс коллоидной химии : поверхностные явления и дисперсные системы.- М.: 1989 г. |
|
Воловик Л.С. та ін. Колоїдна хімія.- К., 1999р. |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.