


ЛПЗ_3.2
Тема : Рішення завдань, пов’язаних з написанням електрохімічних процесів, що відбуваються в гальванічних елементах, при роботі акумулятора, в процесі корозії
Мета : навчити студентів розраховувати ЕРС гальванічних елементів. Складати схеми гальванічних елементів.
Приклад 1. У якому напрямку піде реакція Cu+2AgNO3 = Cu(NО3)2+2Ag в гальванічному елементі, стандартна ЕРС якого дорівнює 0,46 В? Висновок зробіть на підставі розрахунку ΔG° цієї реакції.
Розв’язок
1. Запишемо рівняння електродних процесів, що відбуваються в гальванічному елементі:
(А): Сu0 -2e- = Cu2+
(K): 2Ag+ +2e- = 2Ag0
2.
Обчислимо величину енергії Гіббса цієї реакції: ![]()
Так як у окисно-відновному процесі брали участь 2 електрони, z=2; число Фарадея F = 96 485 Кл.
![]() кДж/моль
кДж/моль
Оскільки значення енергії Гіббса негативне (ΔG<0), можливе протікання прямої реакції.
Відповідь: можливе протікання прямої реакції.
Приклад 2. Які метали не можна одержати шляхом електролізу водних розчинів їх солей? Чому? Скільки кулонів електричного струму потрібно пропустити через розчин CuSO4, щоб виділити 1 г міді?
Розв’язок
При електролізі водних розчинів на катоді відбувається відновлення елементів у вільному стані. В залежності від значення електродного потенціалу можливе відновлення металів чи водню. Метал, який має електродний потенціал більш негативний, ніж потенціал іонів водню, на катоді відновлюватися не буде. В цьому випадку відбуватиметься відновлення водню. В нейтральному середовищі водневий потенціал дорівнює -0,41 В. Отже, за цих умов не можливо одержати шляхом електролізу метали, які розташовані від початку ряду напруг і до титану, тому що їх потенціал є більш негативним.
Для розв’язку задачі скористаємося І та ІІ законами Фарадея:
![]() ;
; 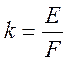 ; звідки:
; звідки: 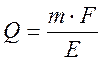
де m – маса металу, Q – кількість струму, Е – еквівалентна маса речовини, F – число Фарадея.
1. Знайдемо еквівалентну масу міді:
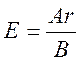
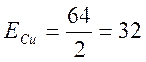 г/моль
г/моль
2. Обчислимо кількість струму, необхідну для відновлення 1г міді (знаючи, що число Фарадея F= 96 485 Kл) :
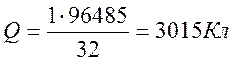
Відповідь: 3 015 Кл
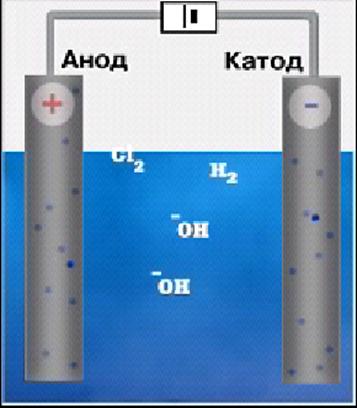
Приклад 3.Записати схему електролізу водного розчину хлориду натрію. Електроліз водного розчину NaCl
При електролізі розчинів солей слід враховувати наявність в розчині води яка під впливом електричного струму дисоціює на катіон водню Н+ та аніон гідроксогрупи ОН-
Е (2Н+/Н2) = -0,41В Е(4ОН- / О2 + 2Н2О)= 1,229 В
Електроліз розчину хлориду натрію NaCl
NaCl Û Na+ + Cl- H2O Û H+ + OH-
Катод Анод
Na+ + 1e à Na0 Е = -2,714В 2Cl- - 2e à Cl20 Е= 1,358В
2H+ + 2e à H2 Е=-0,41В 4 OH- - 4e à O2 + 2H2O Е = 1,220В
Виходячи з відомих закономірностей
на катоді будуть в першу чергу розряджатися той катіон, що має менш негативне значення – водень 2H+ + 2e à H2
на аноді по правилам розряджатися повинні іони ОН , але існує явище перенапруги, яка не дозволяє гідроксильним іонам першими розряджатися на аноді таким чином на аноді буде відбуватися процес 2Cl- - 2e à Cl20
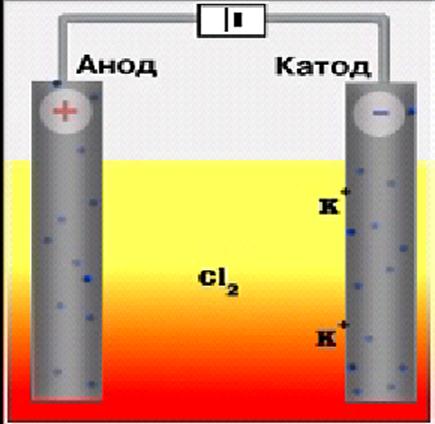
Приклад 4.Записати схему електролізу розплаву хлориду калію.
|
3. Довідковий матеріал : Ряд стандартних електродних потенціалів
4. Запитання для самоперевірки.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.