И.В.Савельев Курс общей физики т.2, гл.Xll (1970г.)
Контрольные вопросы:
1. По какому признаку твёрдые тела делятся на проводники, полупроводники и изоляторы?
2. В чём различия энергетической схемы проводников, полупроводников и изоляторов?
3. При какой температуре нет различия между полупроводниками и изоляторами?
4. Почему электропроводность полупроводников увеличивается при освещении?
5. Перечислите основные характеристики фотосопротивлений.
6. Дайте определение светового потока и силы света.
Лабораторная работа №52
Определение постоянной Ридберга и потенциала ионизации атома водорода.
Приборы и принадлежности: спектроскоп, гелиевая трубка, водородная трубка.
Описание работы:
В работе необходимо изучить спектр водорода, экспериментально определить длину волны различных линий видимой серии его спектра (серии Бальмера), вычислить волновые числа различных линий и по этим значениям вычислить постоянную Ридберга. Для определения длин волн в серии Бальмера необходимо предварительно проградуировать спектроскоп по длинам волн линий на каком – либо известном веществе (обычно гелий).
Схема спектроскопа
 |
К
![]()


![]()
![]()
![]() Т Ф
Т Ф
 |
|||||
![]()
![]()
![]()
![]()
![]()
 0
0
![]()
![]()

![]() S
Р
S
Р
![]()

![]() Ф1
Ф1
рис.1
Атом водорода – простейший из всех атомов. Согласно модели Резерфорда – Бора, он состоит из положительного ядра (протона) и одного электрона, который вращается вокруг ядра. Теория атома водорода основывается на двух постулатах:
1. ![]() Электроны
в атоме могут вращаться вокруг ядра, не излучая, только по орбитам,
для которых момент количества движения (произведение массы m,
скорости V и радиуса r орбиты) равняется целому кратному от h / 2
Электроны
в атоме могут вращаться вокруг ядра, не излучая, только по орбитам,
для которых момент количества движения (произведение массы m,
скорости V и радиуса r орбиты) равняется целому кратному от h / 2 ![]() =
= ![]() .
.
m v r = n ![]() ,
где:
,
где:
n – целое число, соответствующее номеру орбиты, называется главным квантовым числом.
2. Квант энергии излучается (или поглощается) только при переходе электрона с одной стационарной орбиты на другую, причем испущенный (или поглощенный) квант обладает энергией, равной разности энергий электрона на конечной и начальной орбитах.
hν = Еn - Ек , где: h – постоянная Планка.
Еn и Ек - энергии атома в рассматриваемых состояниях.
Если электрон движется по 1-ой орбите, то энергия атома наименьшая из возможных – это нормальное состояние атома.
Состояние атома с n =2 называется возбужденным.
Сериальная формула для серии Бальмера в спектре водорода имеет вид:
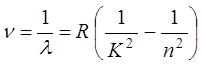
![]() -волновое
число.
-волновое
число.
Знания постоянной Ридберга позволяет рассчитать потенциал ионизации атома водорода по формуле:
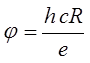
Где h- постоянная Планка, с – скорость света, е- заряд электрона
Ход работы:
В начале опыта устанавливают гелиевую трубку перед спектроскопом так, чтобы капиллярная часть трубки освещала входную щель спектроскопа. При помощи окулярной лупы О получают резкое изображение спектральных линий. Затем определяют положение каждой спектральной линии, записывают отсчет по микрометру в таблицу 1 и строят градуировочную кривую.
Спектр гелия
|
Цвет линий |
красный |
желтый |
зеленый |
голубой |
синий |
фиолетовый |
||
|
Длины волн |
I 7065 |
II 6678 |
5876 |
5030 |
4922 |
4713 |
I 4471 |
II 4338 |
|
Положение линий I,II |
||||||||
|
Отсчет по шкале |
||||||||
Таблица 1.
После градуировки определяют длины волн в спектре водорода. Для этого трубку с гелием заменяют на трубку с водородом и определяют положение каждой линии спектра на шкале прибора.
Результаты наблюдений записывают в таблицу №2.
|
Цвет линий |
Положение на шкале прибора |
Длина волны (см) |
Волновое число |
Постоянная Ридберга
|
Потенциал ионизации |
|
красный |
|||||
|
зеленый |
|||||
|
голубой |
|||||
|
фиолетовый |
Таблица 2
Далее, пользуясь градуировочной кривой, определяют длины волн водородного спектра. Данные заносят в таблицу №2 и производят необходимые вычисления постоянной Ридберга и потенциала ионизации.
Вопросы для самопроверки:
1. Сформулируйте постулаты Бора.
2. Когда атом находится в нормальном состоянии?
3. Когда атом находится в возбужденном состоянии?
4. В чем заключается градуировка спектроскопа?
5. На каком физическом явлении основана работа спектроскопа?
6. из каких характерных серий состоит спектр атома водорода?
7. напишите сериальную формулу Бальмера и объясните ее смысл.
8. дайте определение потенциалу ионизации.
Литература:
Г. А. Зисман, О. М. Тодес, Курс общей физики т. 3, 1965, §44, §50
Р. И. Грабовский, Курс физики, 1974, §132.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.