расчёты производят по итоговым формулам (2) и (3).
Таблица 1
|
№ опыта |
Температура воздуха |
Показа-ние ротаме-тра V1 л/мин |
Показа-ние миллиам-перметра I мА |
Показа-ние вольтмет-ра U В |
Барометрическое давление P1 мм.рт.ст. |
Примеча-ние |
|
|
На входе t1, |
На выходе T2, |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
1.3 Обработка результатов измерений.
По опытным данным средняя объёмная теплоёмкость при постоянном давлении может быть найдена из уравнения теплового баланса калориметра в стационарном режиме
Qн - Qпот = QB,
Где теплота, выделяемая нагревателем Qн = U![]() I
I![]() 10-3, КВт;
10-3, КВт;
тепловые потери Qпот=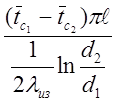 ;
;
теплота, подводимая к воздуху Qв=![]() кВт.
кВт.
В этих формулах:
U – напряжение нагревателя, В;
I – сила тока нагревателя, А;
![]() - средняя температура изоляции
соответственно с внутренней и внешней её стороны, 0 С;
- средняя температура изоляции
соответственно с внутренней и внешней её стороны, 0 С;
![]() - длина калориметра, м;
- длина калориметра, м;
![]() =
= ![]() _
_
_
_ 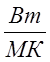 - коэффициент теплоизводности
теплоизоляционного материала;
- коэффициент теплоизводности
теплоизоляционного материала;
d1, d2 – внутренний и внешний диаметры тепловой изоляции, м;
![]() - средняя (в интервале температур t1 и t2) объёмная теплоёмкость
воздуха при постоянном давлении,
- средняя (в интервале температур t1 и t2) объёмная теплоёмкость
воздуха при постоянном давлении, 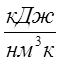 ;
;
(t2 – t1) – разность температур
воздуха на выходе и входе калориметра,![]() С;
С;
V – расход воздуха через калориметр, приведенный к н. ф. у.
V=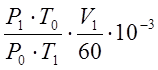 , нм3/с
, нм3/с
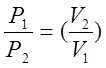 к (1)
к (1)Логарифмируя это равенство и разрешая его относительно К, получим
К=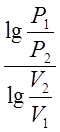 (2)
(2)
Показатель адиабаты К для идеального газа равен отношению теплоёмкостей при постоянном давлении и постоянном объёме
К=![]()
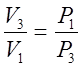 ,
но V3=V2
,
но V3=V2
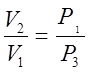 .
.
Подставив найденное отношение объёмов в (2),
получим К=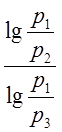
Описанный метод был усовершенствован Рентгеном, который получил обширный экспериментальный материал для большинства идеальных газов при комнатной температуре.
2.1 Описание установки.

1 2 3
4
H В атмосферу
Рис.3. Схема установки
2.2 Порядок проведения опыта.
С помощью компрессора нагнетают в сосуд воздух так, чтобы перепад уровней по манометру H1 был порядка 300-500 мм H2О. Создавать перепад давлений более 500 мм H2О во время эксперимента не рекомендуется.
После заполнения сжатым воздухом сосуд запирают краном 2 и ждут, когда воздух в сосуде примет температуру окружающей среды. Равенство температур воздуха в сосуде и окружающей среде соответствует установившемуся перепаду давлений H1 по манометру, (точка 1 на рис.2). Соеденив сосуд с атмосферой, осуществляют адиабатное расширение воздуха до атмосферного давления Р2( процесс 1-2 рис. 2)
В момент окончания адиабатного расширения, что соответствует нулевому перепаду давлений по манометру, быстро перекрывают кран, разобщая сосуд с атмосферой. Соответствующее состояние газа в сосуде изобразится точкой «2» на диаграмме P-V(рис.2).
Так как температура воздуха в сосуде в процессе адиабатного расширения падает, то в момент закрытия крана она будет ниже температуры окружающего воздуха. Воздух в закрытом сосуде будет нагреваться при постоянном объёме(процесс 2-3 на рис.2) за счёт теплообмена с окружающей средой. Процесс прекращается, когда температуры в помещении и сосуде станут равными, что соответствует усиановившемуся перепаду давлений H2 по манометру ( на рис. 2 точки 3 и 1 лежат на одной изотерме Т1=Т3). Опыт проводится 3 раза. Результаты измерений заносятся в табл. 2.
Таблица 2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.