




Жуков Г. ХТ – 03 – 1
Тема: «Химическое равновесие»
С6Н12 →3Н2 + С6Н6
гексен-1
1. Используя справочную литературу, рассчитать lgKf в интервале 500-1000 К с шагом 100.
|
T,K |
lgKfобр |
lgKf реакции |
|
|
С6H12 |
С6Н6 |
||
|
500 |
-18,766 |
-17,152 |
1,614 |
|
600 |
-19,817 |
-15,901 |
3,916 |
|
700 |
-20,636 |
-15,051 |
5,585 |
|
800 |
-21,282 |
-14,434 |
6,848 |
|
900 |
-21,811 |
-13,97 |
7,841 |
|
1000 |
-22,246 |
-13,608 |
8,638 |
lgKf= lgKfобр(С6Н12)- lgKfобр(С6Н6)
lgKf500= 18,766+-17,152=1,614 ккал
lgKf600=19,817+-15,901=3,916 ккал
lgKf700=20,636+-15,051=5,585 ккал
lgKf800= 21,282+-14,434=6,848 ккал
lgKf900=21,811+-13,97=7,841 ккал
lgKf1000=22,246+-13,608=8,638ккал
2. Вычислить составы равновесной смеси при температуре 600 и давлениях 1; 10; 20; 35; 50 атм.
а) T=600 К
p=1 атм
С6H12 = 3H2 + С6Н6
|
lgKp(600) |
-19,817 |
-15,901 |
|
|
N |
(1-x)/(3х+1) |
(3х)/(3х+1) |
x/(3х+1) |
|
N = |
0,000 |
0,750 |
0,250 |
|
ω |
0,000 |
0,071 |
0,929 |
При давлении 1 атм систему можно считать идеальной. Тогда γ для каждого вещества равны 1, f = p
π=p/pкр
τ=T/Tкр
LgKN=LgKf-LgKY-3*LgP = LgKf
LgKN=3,916
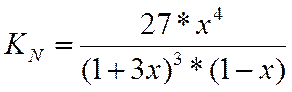
Зная константу равновесия, определяем х и находим состав равновесной смеси.
В таблицах максимальное значение константы равновесия 1,923, при этом значение х = 0,995. Тогда при LgKN=3,916 х≈1.
NA=(1-x)/(3х+1) = 0
NB=(3х)/(3х+1)= 0,75
NC=x/(3х+1)= 0,25
ωA=(1-x)*84/84 =(1-x)84/84=1-x =0
ωB=(3x)*2/84 =x/14=0.071
ωB=x*78/84 =0.929
б) T=600 К
p=10 атм
С6H12 = 3H2 + С6Н6
|
lgKp(600) |
-19,817 |
-15,901 |
|
|
Tкр |
504 |
33,3 |
562,7 |
|
Ркр |
42,9 |
12,8 |
38 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
π |
0,23 |
0,48 |
0,26 |
|
τ |
1,19 |
14,53 |
1,07 |
|
γ |
0,97 |
1 |
0,95 |
|
N |
0,012 |
0,741 |
0,247 |
|
ω |
0,047 |
0,068 |
0,885 |
π=p/pкр
τ=T/Tкр
Для С6H12
π=10/42,9=0,23.
τ=600/504=1,19.
По графику находим γ=0.97.
Для H2
π=p/(pкр+8)=10/(12,8+8)=0,48.
τ==T/(Tкр+8)=1000/(33.3+8)= 14,53.
По графику находим γ=1.
Для С6H6
π=10/38=0,26.
τ=600/562,7=1,07.
По графику находим γ=0.95.
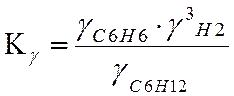
Ky=0,979 lgKy=-0,009
LgKN=LgKf-LgKY-3*LgP
LgKN=0,925
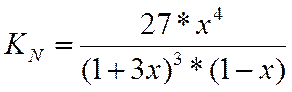
Зная константу равновесия, определяем х и находим состав равновесной смеси.
Х находим методом интерполяции, из таблиц.
|
x |
lgKN |
|
0,95 |
0,887 |
|
0,97 |
1,1253 |
|
0,02 |
0,2383 |
|
∆х |
0,038 |
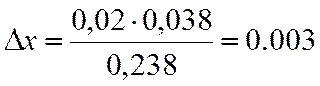
х=0,95+0,003=0,953
NA=(1-x)/(3х+1) = 0,012
NB=(3х)/(3х+1)= 0,741
NC=x/(3х+1)= 0,247
в) T=600 К
p=20 атм
С6H12 = 3H2 + С6Н6
|
lgKp(600) |
-19,817 |
-15,901 |
|
|
Tкр |
504 |
33,3 |
562,7 |
|
Ркр |
42,9 |
12,8 |
38 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
π |
0,47 |
0,96 |
0,53 |
|
τ |
1,19 |
14,53 |
1,07 |
|
γ |
0,92 |
1 |
0,88 |
|
N |
0,073 |
0,695 |
0,232 |
|
ω |
0,240 |
0,054 |
0,705 |
Ky=0,957 lgKy=-0,019
LgKN=LgKf-LgKY-3*LgP
LgKN=0,032
|
x |
lgKN |
|
0,7 |
-0,139 |
|
0,8 |
0,148 |
|
0,1 |
0,287 |
|
∆х |
0,171 |
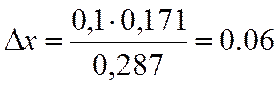
х=0,7+0,06=0,76
NA=(1-x)/(3х+1) = 0,073
NB=(3х)/(3х+1)= 0,695
NC=x/(3х+1)= 0,232
г) T=600 К
p=35 атм
С6H12 = 3H2 + С6Н6
|
lgKp(600) |
-19,817 |
-15,901 |
|
|
Tкр |
504 |
33,3 |
562,7 |
|
Ркр |
42,9 |
12,8 |
38 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
π |
0,82 |
1,68 |
0,92 |
|
τ |
1,19 |
14,53 |
1,07 |
|
γ |
0,86 |
1 |
0,79 |
|
N |
0,203 |
0,598 |
0,199 |
|
ω |
0,504 |
0,035 |
0,460 |
Ky=0,919 lgKy=-0,037
LgKN=LgKf-LgKY-3*LgP
LgKN=-0,679
|
x |
lgKN |
|
0,4 |
-0,966 |
|
0,5 |
-0,666 |
|
0,1 |
0,3 |
|
∆х |
0,287 |
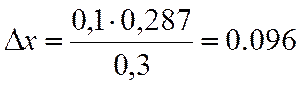
х=0,4+0,096=0,496
NA=(1-x)/(3х+1) = 0,203
NB=(3х)/(3х+1)= 0,598
NC=x/(3х+1)= 0,199
д) T=600 К
p=50 атм
С6H12 = 3H2 + С6Н6
|
lgKp(600) |
-19,817 |
-15,901 |
|
|
Tкр |
504 |
33,3 |
562,7 |
|
Ркр |
42,9 |
12,8 |
38 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
π |
1,17 |
2,40 |
1,32 |
|
τ |
1,19 |
14,53 |
1,07 |
|
γ |
0,8 |
1 |
0,68 |
|
N |
0,306 |
0,520 |
0,173 |
|
ω |
0,638 |
0,026 |
0,336 |
Ky=0,850 lgKy=-0,071
LgKN=LgKf-LgKY-3*LgP
LgKN=-1,110
|
x |
lgKN |
|
0,3 |
-1,341 |
|
0,4 |
-0,966 |
|
0,1 |
0,375 |
|
∆х |
0,231 |
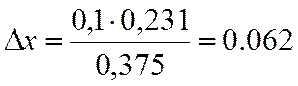
х=0,3+0,062=0,362
NA=(1-x)/(3х+1) = 0,306
NB=(3х)/(3х+1)= 0,520
NC=x/(3х+1)= 0,173
Получили
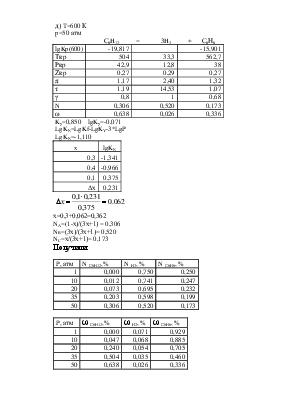
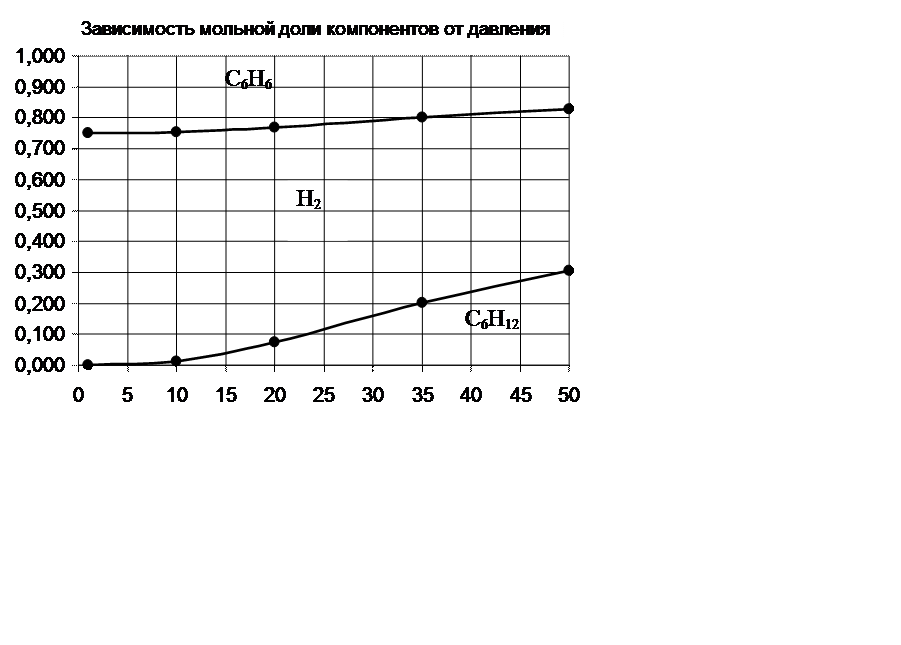
|
P, атм |
N С6H12,% |
N H2, % |
N С6Н6, % |
|
1 |
0,000 |
0,750 |
0,250 |
|
10 |
0,012 |
0,741 |
0,247 |
|
20 |
0,073 |
0,695 |
0,232 |
|
35 |
0,203 |
0,598 |
0,199 |
|
50 |
0,306 |
0,520 |
0,173 |
|
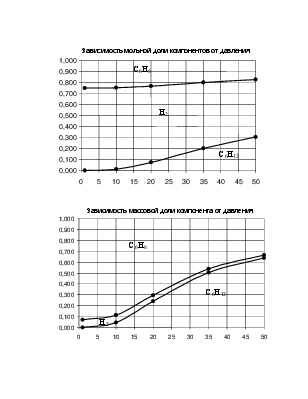
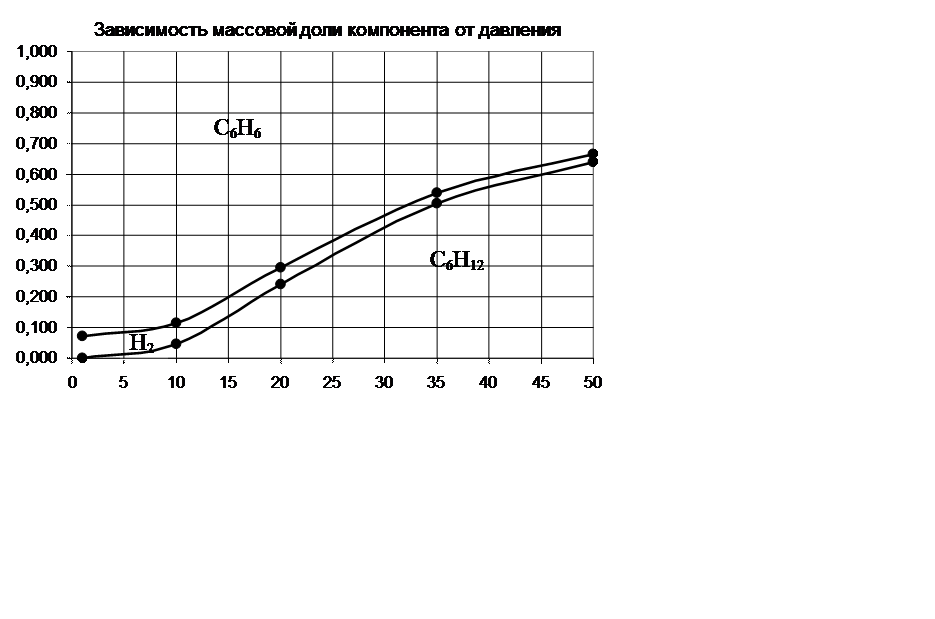
P, атм |
ω С6H12,% |
ω H2, % |
ω С6Н6, % |
|
1 |
0,000 |
0,071 |
0,929 |
|
10 |
0,047 |
0,068 |
0,885 |
|
20 |
0,240 |
0,054 |
0,705 |
|
35 |
0,504 |
0,035 |
0,460 |
|
50 |
0,638 |
0,026 |
0,336 |
3. Вычислить тепловой эффект данной реакции при Т=600 К и давлении 35 атм.
С6H12 = 3H2 + С6Н6
|
∆H600 обр |
-15,16 |
0 |
16,71 |
|
τ |
1,19 |
14,53 |
1,07 |
|
π |
0,82 |
1,68 |
0,92 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
Tкр |
504 |
33,3 |
562,7 |
|
(H0-H)/Tкр |
1,421 |
0 |
2,369 |
|
H0-H |
716,2 |
0 |
1333,0 |
(H0-H)/Tкр определяется по таблицам, в зависимости от τ, π, Zкр.
(H0-H)= (H0-H)/Tкр*Ткр
∆(H0-H) = 616,9 кал
∆H6000 =31,87 ккал
∆H60035 =31,25 ккал
4. Анализ полученных результатов.
По принципу Ле-Шателье равновесие реакции при повышении давления смещается в сторону уменьшения объёма. В реакции С6H12=3H2 +С6Н6 вступает 1 моль веществ, получается 4 моль. Следовательно, при повышении давления равновесие должно смещаться в сторону обратной реакции. Это видно на диаграмме –
молярная доля исходного вещества – гексена растет с повышением давления, а водорода и бензола уменьшается.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.