




Махошвили М. ХТ-03-2
Домашнее задание №2
Для химической реакции, проводимой в газовой фазе в стандартных условиях:
С3Н6 + СО2 + Н2 → С2Н5СООСН3
1. Используя справочную литературу, определить lgKf в интервале 300-600 К с шагом 100.
|
T,K |
lgKfобр |
|||
|
С3Н6 |
СО2 |
Н2 |
С4Н8О2 |
|
|
300 |
-10,966 |
68,666 |
0 |
56,882 |
|
350 |
-10,571 |
60,101 |
0 |
47,176 |
|
400 |
-10,175 |
51,535 |
0 |
37,47 |
|
500 |
-9,814 |
41,255 |
0 |
25,675 |
|
600 |
-9,638 |
34,4 |
0 |
17,733 |
2. Вычислить составы равновесной смеси при температуре 350 и давлениях 1, 20, 60, 80 атм.
а) Для p =1 атм
С3Н6 + СО2 + Н2 → С4Н8О2
|
lgKp(350) |
-10,571 |
60,101 |
0,000 |
47,176 |
|
Tкр |
365 |
304,2 |
33,3 |
523,3 |
|
Ркр |
45,6 |
72,9 |
12,8 |
37,8 |
|
Zкр |
0,27 |
0,27 |
0,29 |
0,25 |
|
N |
0,333 |
0,333 |
0,333 |
0,001 |
При низких давлениях (1 атм) систему можно считать идеальной. γ = 1
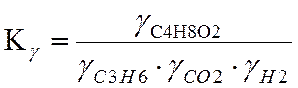
![]() =
1
=
1
lgKγ=0
LgKN=LgKf -LgKY + 2*LgP = LgKN
LgKN = -2,354
А + B + C = D
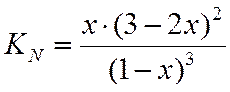
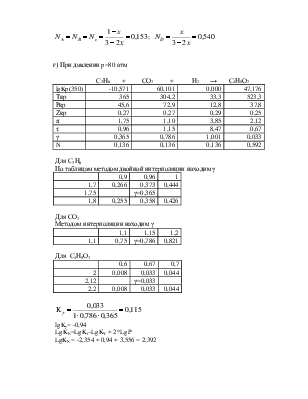
Зная константу равновесия, определяем х и находим состав равновесной смеси, х находим методом интерполяции, из таблиц.
Так как такой реакции нет в таблицах, а есть только обратная, то lgK берем с противоположным знаком, х определяем, отнимая от 1 число, получающееся в левой колонке.
|
x |
lgKn |
|
0,0001 |
-3,056 |
|
0,002 |
-2,354 |
|
0,005 |
-1,343 |
х=0,002
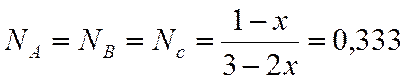 ;
;
;
; 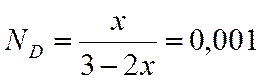
б) Для p = 20 атм
С3Н6 + СО2 + Н2 → С4Н8О2
|
lgKp(350) |
-10,571 |
60,101 |
0,000 |
47,176 |
|
Tкр |
365 |
304,2 |
33,3 |
523,3 |
|
Ркр |
45,6 |
72,9 |
12,8 |
37,8 |
|
Zкр |
0,27 |
0,27 |
0,29 |
0,25 |
|
π |
0,44 |
0,27 |
0,96 |
0,53 |
|
τ |
0,96 |
1,15 |
8,47 |
0,67 |
|
γ |
0,79 |
0,956 |
1 |
0,062 |
|
N |
0,193 |
0,193 |
0,193 |
0,421 |
Для С3Н6
π = p/pкр = 20/45,6=0,44.
τ = 350/365 = 0,96.
По таблицам методом двойной интерполяции находим γ
|
0,9 |
0,96 |
1 |
|
|
0,4 |
0,62 |
0,775 |
0,879 |
|
0,44 |
γ=0,79 |
||
|
0,5 |
0,759 |
0,811 |
0,846 |
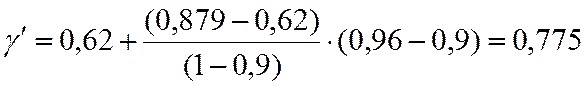
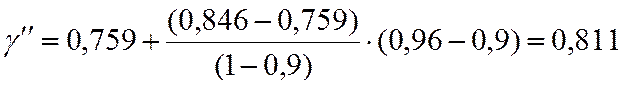
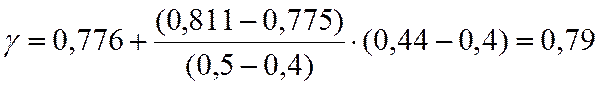
Для СО2
π = 20/72,9 = 0,27
τ=350/304,2=1,15
Методом двойной интерполяции находим γ
|
1,1 |
1,15 |
1,2 |
|
|
0,2 |
0,967 |
0,971 |
0,974 |
|
0,27 |
γ=0,956 |
||
|
0,3 |
0,942 |
0,950 |
0,958 |
Для Н2
π = р/(ркр+8) = 20/(12,8+8) = 0,96
τ = Т/(Ткр+8) = 350/(33,3+8) =8,47
По таблице γ=1
Для С4Н8О2
π = 20/37,8 = 0,53
τ=350/523,3=0,67
|
0,6 |
0,67 |
0,7 |
|
|
0,5 |
0,0155 |
0,066 |
0,087 |
|
0,53 |
γ=0,062 |
||
|
0,6 |
0,0126 |
0,055 |
0,073 |
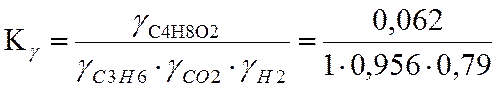
![]() =
0,082
=
0,082
lgKγ= -1,086
LgKN=LgKf -LgKY + 2*LgP
LgKN = -2,354 + 1,086 + 2,602 = 1,334
Интерполяцией находим х
|
x |
lgKn |
|
0,6 |
1,2552 |
|
х=0,686 |
1,334 |
|
0,7 |
1,822 |
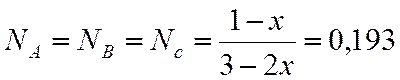 ;
;
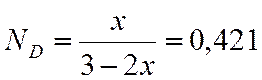
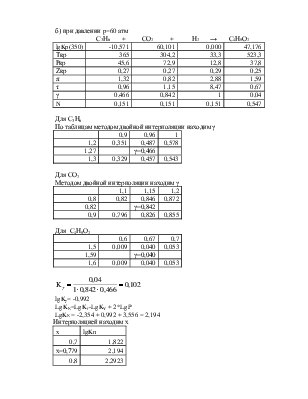
б) при давлении p=60 атм
С3Н6 + СО2 + Н2 → С4Н8О2
|
lgKp(350) |
-10,571 |
60,101 |
0,000 |
47,176 |
|
Tкр |
365 |
304,2 |
33,3 |
523,3 |
|
Ркр |
45,6 |
72,9 |
12,8 |
37,8 |
|
Zкр |
0,27 |
0,27 |
0,29 |
0,25 |
|
π |
1,32 |
0,82 |
2,88 |
1,59 |
|
τ |
0,96 |
1,15 |
8,47 |
0,67 |
|
γ |
0,466 |
0,842 |
1 |
0,04 |
|
N |
0,151 |
0,151 |
0,151 |
0,547 |
Для С3Н6
По таблицам методом двойной интерполяции находим γ
|
0,9 |
0,96 |
1 |
|
|
1,2 |
0,351 |
0,487 |
0,578 |
|
1,27 |
γ=0,466 |
||
|
1,3 |
0,329 |
0,457 |
0,543 |
Для СО2
Методом двойной интерполяции находим γ
|
1,1 |
1,15 |
1,2 |
|
|
0,8 |
0,82 |
0,846 |
0,872 |
|
0,82 |
γ=0,842 |
||
|
0,9 |
0,796 |
0,826 |
0,855 |
Для С4Н8О2
|
0,6 |
0,67 |
0,7 |
|
|
1,5 |
0,009 |
0,040 |
0,053 |
|
1,59 |
γ=0,040 |
||
|
1,6 |
0,009 |
0,040 |
0,053 |
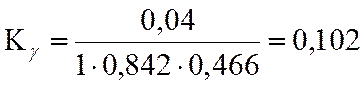
lgKγ= -0,992
LgKN=LgKf -LgKY + 2*LgP
LgKN = -2,354 + 0,992 + 3,556 = 2,194
Интерполяцией находим х
|
x |
lgKn |
|
0,7 |
1,822 |
|
х=0,779 |
2,194 |
|
0,8 |
2,2923 |
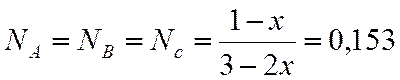 ;
;
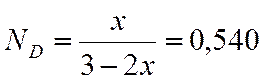
г) При давлении p=80 атм
С3Н6 + СО2 + Н2 → С4Н8О2
|
lgKp(350) |
-10,571 |
60,101 |
0,000 |
47,176 |
|
Tкр |
365 |
304,2 |
33,3 |
523,3 |
|
Ркр |
45,6 |
72,9 |
12,8 |
37,8 |
|
Zкр |
0,27 |
0,27 |
0,29 |
0,25 |
|
π |
1,75 |
1,10 |
3,85 |
2,12 |
|
τ |
0,96 |
1,15 |
8,47 |
0,67 |
|
γ |
0,365 |
0,786 |
1,001 |
0,033 |
|
N |
0,136 |
0,136 |
0,136 |
0,592 |
Для С3Н6
По таблицам методом двойной интерполяции находим γ
|
0,9 |
0,96 |
1 |
|
|
1,7 |
0,266 |
0,373 |
0,444 |
|
1,75 |
γ=0,365 |
||
|
1,8 |
0,255 |
0,358 |
0,426 |
Для СО2
Методом интерполяции находим γ
|
1,1 |
1,15 |
1,2 |
|
|
1,1 |
0,75 |
γ=0,786 |
0,821 |
Для С4Н8О2
|
0,6 |
0,67 |
0,7 |
|
|
2 |
0,008 |
0,033 |
0,044 |
|
2,12 |
γ=0,033 |
||
|
2,2 |
0,008 |
0,033 |
0,044 |
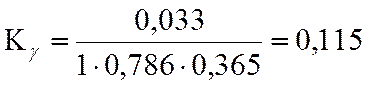
lgKγ= -0,94
LgKN=LgKf -LgKY + 2*LgP
LgKN = -2,354 + 0,94 + 3,556 = 2,392
Интерполяцией находим х
|
x |
lgKn |
|
0,8 |
2,2923 |
|
х=0,813 |
2,401 |
|
0,9 |
3,1126 |
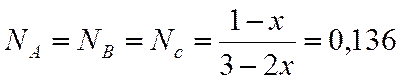 ;
;
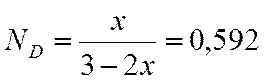
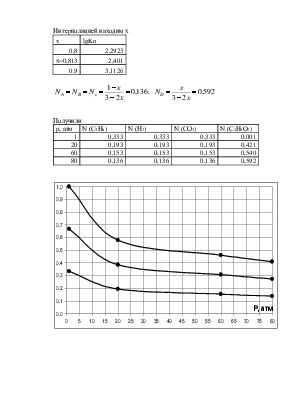
Получили
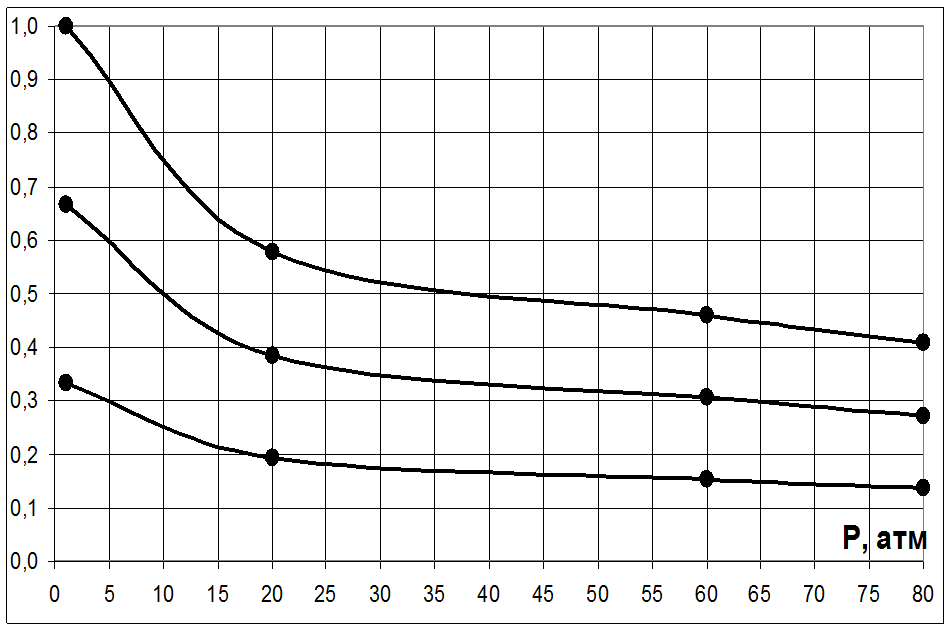
|
p, атм |
N (С3Н6) |
N (Н2) |
N (СО2) |
N (С4Н8О2) |
|
1 |
0,333 |
0,333 |
0,333 |
0,001 |
|
20 |
0,193 |
0,193 |
0,193 |
0,421 |
|
60 |
0,153 |
0,153 |
0,153 |
0,540 |
|
80 |
0,136 |
0,136 |
0,136 |
0,592 |
3. Вычислить тепловой эффект данной реакции при Т=350 К и давлении 80 атм.
С3Н6 + СО2 + Н2 → С4Н8О2
|
∆H обр,ккал |
4,31 |
-94,06 |
0 |
-138,325 |
|
τ |
0,96 |
1,15 |
8,47 |
0,67 |
|
π |
1,75 |
1,10 |
3,85 |
2,12 |
|
Zкр |
0,27 |
0,27 |
0,29 |
0,25 |
|
Tкр |
365 |
304,2 |
33,3 |
523,3 |
|
(H0-H)/Tкр |
1,027 |
2,405 |
0,013 |
12,822 |
|
(H0-H), кал |
374,9 |
731,6 |
0,4 |
6709,8 |
(H0-H)/Tкр определяется по таблицам, в зависимости от τ, π, Zкр.
Для С3Н6
|
0,9 |
0,96 |
1 |
|
|
1,7 |
10,24 |
9,178 |
8,47 |
|
1,75 |
9,206 |
||
|
1,8 |
10,26 |
9,234 |
8,55 |
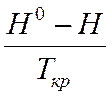 =9,206
=9,206
Для СО2
|
1,1 |
1,15 |
1,2 |
|
|
1,1 |
2,79 |
2,405 |
2,02 |
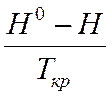 =2,405
=2,405
Для Н2
|
8 |
8,47 |
10 |
|
|
3,5 |
0,01 |
0,008 |
0 |
|
3,85 |
0,013 |
||
|
4 |
0,02 |
0,015 |
0 |
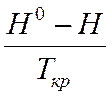 =0,013
=0,013
Для С4Н8О2
|
0,6 |
0,67 |
0,7 |
|
|
2 |
13,72 |
12,859 |
12,49 |
|
2,12 |
12,837 |
||
|
2,2 |
13,69 |
12,822 |
12,45 |
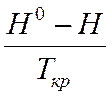 =12,837
=12,837
(H0-H)
= 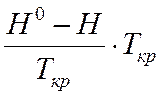
∆(H0-H) = 6709,8 – 0,4 – 731,6 – 374,9 = 5602,9 кал
∆H3500 = -138,325 + 94,06 – 4,31 = - 48,575 ккал
∆H35080 =∆H3500 - ∆(H0-H) = - 48,575 – 5,603 = - 54,18 ккал
4. Анализ полученных результатов.
Согласно принципу Ле-Шателье равновесие реакции при повышении давления смещается в сторону уменьшения объёма. В реакции С3Н6 + СО2 + Н2→ С4Н8О2 вступает 3 моль веществ, образуется 1 моль. При повышении давления равновесие должно смещаться в сторону прямой реакции, в сторону образования
продукта. Это видно на диаграмме – мольная доля исходных веществ уменьшается, продукта растет.
При проведение реакции при повышенном давлении изменяется тепловой эффект. Так при 80 атм тепл. эффект увеличивается на 5,6 ккал по сравнению с реакцией, проводимой в стандартных условиях.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.