Для химической реакции, проводимой в газовой фазе в стандартных условиях:
С6Н5СН=СН2 + Н2 → С6Н5С3Н5
1. Используя справочную литературу, рассчитать lgKf в интервале 500-1000 К с шагом 100.
|
T,K |
lgKfобр |
lgKf реакции |
|
|
С6H5C2H3 |
С6Н5С2Н5 |
||
|
500 |
-25,364 |
-21,222 |
4,142 |
|
600 |
-25,01 |
-20,992 |
4,018 |
|
700 |
-23,376 |
-20,89 |
2,486 |
|
800 |
-22,171 |
-20,842 |
1,329 |
|
900 |
-21,252 |
-20,827 |
0,425 |
|
1000 |
-20,526 |
-20,826 |
-0,3 |
lgKf= lgKfобр(С6Н5С2Н5)- lgKfобр(С6Н5С2Н3)
lgKf500=-22,222+25,364=3,142 ккал
lgKf600=-20,992+25,01=4,018 ккал
lgKf700=-20,89+23,376=2,486 ккал
lgKf800=-20,842+22,171=1,329 ккал
lgKf900=-20,827+21,252=0,425 ккал
lgKf1000=-20,826+20,256=-0,3 ккал
2. Вычислить составы равновесной смеси при температуре 1000 и давлениях 1; 10; 35; 45; 60 атм.
а) T=1000 К
p=1 атм
С6H5C2H3 + H2 = С6Н5С2Н5
|
lgKp(1000) |
-20,526 |
-20,826 |
|
|
Tкр |
546 |
32,2 |
619,5 |
|
Ркр |
40 |
12,8 |
38 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
π |
0,03 |
0,05 |
0,03 |
|
τ |
1,83 |
24,88 |
1,61 |
|
γ |
1 |
1 |
1 |
|
N |
0,448 |
0,448 |
0,103 |
π=p/pкр
τ=T/Tкр
Для С6H5C2H3
π=1/40=0,03.
τ=1000/546=1.83.
По графику зависимости γ=f(π, τ) находим γ=1.
Для С6H5C2H5
π=1/38=0,03.
τ=1000/619,5=1,61.
По графику зависимости γ=f(π, τ) находим γ=1.
Для H2
π=p/(pкр+8)=1/(12,8+8)=0,05.
τ==T/(Tкр+8)=1000/(32.2+8)= 24,88.
По графику находим γ=1.
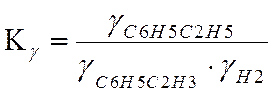
![]() =
1
=
1
Kγ=1 lgKγ=0
LgKN=LgKf -LgKY+LgP
LgKN=-0,3 – 0 + 0,
LgKN=-0,3
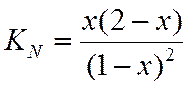
Зная константу равновесия, определяем х и находим состав равновесной смеси.
Х находим методом интерполяции, из таблиц.
|
x |
lgKN |
|
0,1 |
-0,63 |
|
0,2 |
-0,25 |
|
0,1 |
0,38 |
|
∆х |
0,05 |
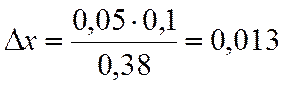
х=0,2-0,013=0,187
NA=(1-x)/(2-x)= 0,448
NB=(1-x)/(2-x)= 0,448
NC=x/(2-x)= 0,103
б) T=1000 К
p=10 атм
С6H5C2H3 + H2 = С6Н5С2Н5
|
lgKp(1000) |
-20,526 |
-20,826 |
|
|
Tкр |
546 |
32,2 |
619,5 |
|
Ркр |
40 |
12,8 |
38 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
π |
0,25 |
0,48 |
0,26 |
|
τ |
1,83 |
24,88 |
1,61 |
|
γ |
0,99 |
1 |
0,99 |
|
N |
0,290 |
0,290 |
0,420 |
Для С6H5C2H3
π=10/40=0,25.
τ=1000/546=1.83.
По графику находим γ=0.99.
Для H2
π=p/(pкр+8)=10/(12,8+8)=0,48.
τ==T/(Tкр+8)=1000/(32.2+8)= 24,88.
По графику находим γ=1.
Для С6H5C2H5
π=10/38=0,26.
τ=1000/619,5=1,61.
По графику находим γ=0.99.
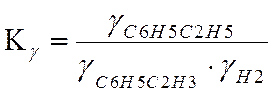
Ky=1 lgKy=0
LgKN=LgKf-LgKY+LgP
LgKN=0,7
Зная константу равновесия, определяем х и находим состав равновесной смеси.
Х находим методом интерполяции, из таблиц.
|
x |
lgKn |
|
0,5 |
0,477 |
|
0,6 |
0,72 |
|
0.1 |
0.243 |
|
∆х |
0,02 |
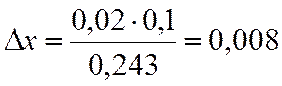
х=0,6-0,008=0,592
NA=(1-x)/(2-x)= 0,290
NB=(1-x)/(2-x)= 0,290
NC=x/(2-x)= 0,420
в) T=1000 К
p=35 атм
С6H5C2H3 + H2 = С6Н5С2Н5
|
lgKp(1000) |
-20,526 |
-20,826 |
|
|
Tкр |
546 |
32,2 |
619,5 |
|
Ркр |
40 |
12,8 |
38 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
π |
0,88 |
1,68 |
0,92 |
|
τ |
1,83 |
24,88 |
1,61 |
|
γ |
0,96 |
1 |
0,95 |
|
N |
0,190 |
0,190 |
0,619 |
Ky=0,990 lgKy=-0,005
LgKN=LgKf-LgKY+LgP
LgKN=1,249
|
x |
lgKn |
|
0,7 |
1,005 |
|
0,8 |
1,38 |
|
0.1 |
0.375 |
|
∆х |
0,131 |
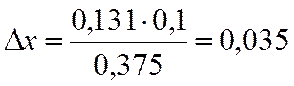
х=0,8-0,035=0,765
NA=(1-x)/(2-x)= 0,190
NB=(1-x)/(2-x)= 0,190
NC=x/(2-x)= 0,619
г) T=1000 К
p=45 атм
С6H5C2H3 H2 С6Н5С2Н5
|
lgKp(1000) |
-20,526 |
-20,826 |
|
|
Tкр |
546 |
32,2 |
619,5 |
|
Ркр |
40 |
12,8 |
38 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
π |
1,13 |
2,16 |
1,18 |
|
τ |
1,83 |
24,88 |
1,61 |
|
γ |
0,95 |
1 |
0,93 |
|
N |
0,170 |
0,170 |
0,660 |
Ky=0,979 lgKy=-0,009
LgKN=LgKf-LgKY+LgP
LgKN=1,362
|
x |
lgKn |
|
0,7 |
1,005 |
|
0,8 |
1,38 |
|
0.1 |
0.375 |
|
∆х |
0,018 |
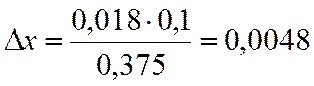
х=0,8-0,0048=0,795
NA=(1-x)/(2-x)= 0,170
NB=(1-x)/(2-x)= 0,170
NC=x/(2-x)= 0,660
д) T=1000 К
p=60 атм
С6H5C2H3 H2 С6Н5С2Н5
|
lgKp(1000) |
-20,526 |
-20,826 |
|
|
Tкр |
546 |
32,2 |
619,5 |
|
Ркр |
40 |
12,8 |
38 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
π |
1,50 |
2,88 |
1,58 |
|
τ |
1,83 |
24,88 |
1,61 |
|
γ |
0,94 |
1 |
0,91 |
|
N |
0,154 |
0,154 |
0,692 |
Ky=0,968 lgKy=-0,014
LgKN=LgKf-LgKY+LgP
LgKN=1,492
|
x |
lgKn |
|
0,8 |
1,38 |
|
0,9 |
1,996 |
|
0.1 |
0,616 |
|
∆х |
0,504 |
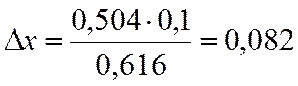
х=0,9-0,082=0,818
NA=(1-x)/(2-x)= 0,154
NB=(1-x)/(2-x)= 0,154
NC=x/(2-x)= 0,692
Получили
|
P, атм |
N С6H5C2H3,% |
N H2, % |
N С6Н5С2Н5, % |
|
1 |
0,45 |
0,45 |
0,10 |
|
10 |
0,29 |
0,29 |
0,42 |
|
35 |
0,19 |
0,19 |
0,62 |
|
45 |
0,17 |
0,17 |
0,66 |
|
60 |
0,15 |
0,15 |
0,69 |
3. Вычислить тепловой эффект данной реакции при Т=1000 К и давлении 60 атм.
С6H5C2H3 + H2 = С6Н5С2Н5
|
∆H1000 обр |
29,83 |
0 |
-0,05 |
|
τ |
1,83 |
24,88 |
1,61 |
|
π |
1,50 |
2,88 |
1,58 |
|
Zкр |
0,27 |
0,29 |
0,27 |
|
Tкр |
546 |
32,2 |
619,5 |
|
(H0-H)/Tкр |
0,87 |
0 |
1,39 |
|
H0-H |
475,0 |
0 |
861,1 |
(H0-H)/Tкр определяется по таблицам, в зависимости от τ, π, Zкр.
(H0-H)= (H0-H)/Tкр*Ткр
∆(H0-H) =861,1-475,0=386,1 кал
∆H10000 = -0,05-29,83=-29,88 ккал
∆H100060 =∆H10000 - ∆(H0-H) =-29,88 – 0,386= -30,27 ккал
4. Анализ полученных результатов.
Согласно принципу Ле-Шателье равновесие реакции при повышении давления смещается в сторону уменьшения объёма. В реакции С6Н5СН=СН2 + Н2 → С6Н5С3Н5 вступает 2 моля веществ, получается 1 моль. При повышении давления равновесие должно смещаться в сторону прямой реакции, в сторону образования этилбензола – молярная доля исходных веществ – стирола и водорода уменьшается, а молярная доля продукта - этилбензола растет.
С увеличением давления тепловой эффект реакции изменяется, но не сильно. Так, в этой реакции при увеличении давления в 60 раз тепловой эффект изменяется на 0,4 ккал.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.