




Для химической реакции, проводимой в газовой фазе в стандартных условиях:
С9Н20 → СН4 + С2Н4 + 2С3Н6
3-этил 2-метилгексан
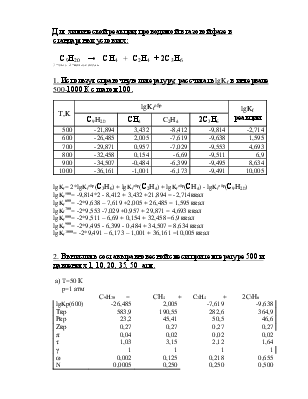
1. Используя справочную литературу, рассчитать lgKf в интервале 500-1000 К с шагом 100.
|
T,K |
lgKfобр |
lgKf реакции |
|||
|
С9H20 |
СН4 |
C2H4 |
2С3Н6 |
||
|
500 |
-21,894 |
3,432 |
-8,412 |
-9,814 |
-2,714 |
|
600 |
-26,485 |
2,005 |
-7,619 |
-9,638 |
1,595 |
|
700 |
-29,871 |
0,957 |
-7,029 |
-9,553 |
4,693 |
|
800 |
-32,458 |
0,154 |
-6,69 |
-9,511 |
6,9 |
|
900 |
-34,507 |
-0,484 |
-6,399 |
-9,495 |
8,634 |
|
1000 |
-36,161 |
-1,001 |
-6,173 |
-9,491 |
10,005 |
lgKf= 2*lgKfобр(С3H6) + lgKfобр(С2H4) + lgKfобр(СH4) - lgKfобр(С9H20)
lgKf500= -9,814*2 - 8,412 + 3,432 +21,894 = -2,714ккал
lgKf600= -2*9,638 – 7,619 +2,005 + 26,485 = 1,595 ккал
lgKf700= -2*9,553 -7,029 +0,957 + 29,871 = 4,693 ккал
lgKf800= -2*9,511 – 6,69 + 0,154 + 32,458 =6,9 ккал
lgKf900= -2*9,495 - 6,399 - 0,484 + 34,507 = 8,634 ккал
lgKf1000= -2*9,491 – 6,173 – 1,001 + 36,161 =10,005 ккал
2. Вычислить составы равновесной смеси при температуре 500 и давлениях 1, 10, 20, 35, 50 атм.
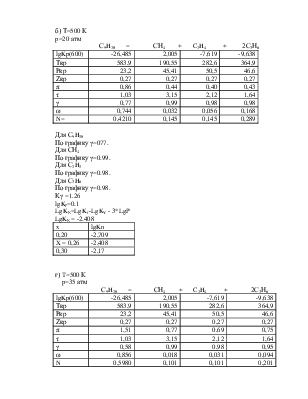
а) T=50 К
p=1 атм
С9H20 = СН4 + C2H4 + 2С3Н6
|
lgKp(600) |
-26,485 |
2,005 |
-7,619 |
-9,638 |
|
Tкр |
583,9 |
190,55 |
282,6 |
364,9 |
|
Ркр |
23,2 |
45,41 |
50,5 |
46,6 |
|
Zкр |
0,27 |
0,27 |
0,27 |
0,27 |
|
π |
0,04 |
0,02 |
0,02 |
0,02 |
|
τ |
1,03 |
3,15 |
2,12 |
1,64 |
|
γ |
1 |
1 |
1 |
1 |
|
ω |
0,002 |
0,125 |
0,218 |
0,655 |
|
N |
0,0005 |
0,250 |
0,250 |
0,500 |
Для С9H20
Отсутствующие критические параметры рассчитываю по методу Лидерсена.
|
Структурные группы |
число групп |
∆т |
∆р |
|
- CH3 |
4 |
0,02 |
0,227 |
|
- СН2 - |
3 |
0,02 |
0,227 |
|
- СН < |
2 |
0,012 |
0,21 |
|
∑ |
0,164 |
2,009 |
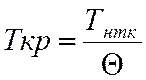
![]() =0,567 + ∑∆т – (∑∆т)2
=0,567 + ∑∆т – (∑∆т)2
![]() =0,704
=0,704
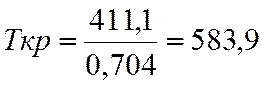
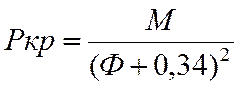
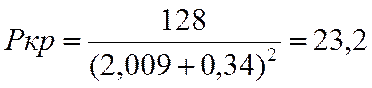
π=p/pкр
τ=T/Tкр
π=1/23,2=0,04.
τ=500/583,9=1,03.
При низких давлениях (1 атм) фугитивность равна давлению, γ =1
Для СH4
π=1/45,4=0,02.
τ=500/190,55=3,15.
γ=1.
Для С2H2
π=1/50,5 =0,02
τ==500/282,5 =2,12.
γ=1.
Для С3H6
π=1/46,6 =0,02
τ==500/364,9 =1,64.
γ=1.
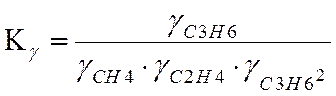
![]() =
1
=
1
lgKγ=0
LgKN=LgKf -LgKY - 3*LgP
LgKN = 1,595
А = В + С + 2D
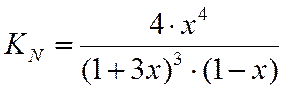
Зная константу равновесия, определяем х и находим состав равновесной смеси.
Х находим методом интерполяции, из таблиц.
|
x |
lgKn |
|
0,995 |
1,093 |
|
X = 0,998 |
1,595 |
|
0,999 |
1,795 |
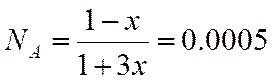 ;
; 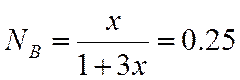 ;
;
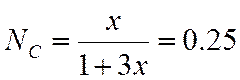
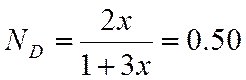
![]()
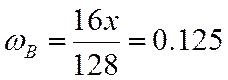 ;
; 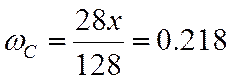 ;
; 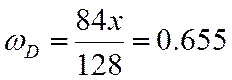
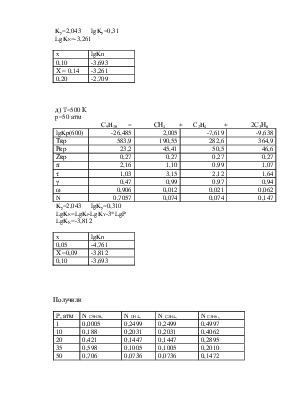
б) T=500 К
p=10 атм
С9H20 = СН4 + C2H4 + 2С3Н6
|
lgKp(600) |
-26,485 |
2,005 |
-7,619 |
-9,638 |
|
Tкр |
583,9 |
190,55 |
282,6 |
364,9 |
|
Ркр |
23,2 |
45,41 |
50,5 |
46,6 |
|
Zкр |
0,27 |
0,27 |
0,27 |
0,27 |
|
π |
0,43 |
0,22 |
0,20 |
0,21 |
|
τ |
1,03 |
3,15 |
2,12 |
1,64 |
|
γ |
0,9 |
0,99 |
0,99 |
0,99 |
|
ω |
0,480 |
0,065 |
0,114 |
0,341 |
|
N |
0,1876 |
0,203 |
0,203 |
0,406 |
Для С9H20
π=10/23,2=0,43.
τ=500/583,9=1,03.
По графику зависимости γ=f(π, τ) находим γ=0.90.
Для СH4
π=10/45,4=0,22.
τ=500/190,55=3,15.
По графику зависимости γ=f(π, τ) находим γ=0.99.
Для С2H2
π=10/50,5 =0,2
τ=500/282,5 =2,12.
По графику зависимости γ=f(π, τ) находим γ=0.99.
Для С3H6
π=10/46,6 =0,21
τ==500/364,9 =1,64.
По графику зависимости γ=f(π, τ) находим γ=0.99.
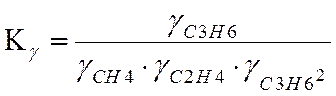
![]() = 1.089
= 1.089
lgKγ=0.037
LgKN=LgKf -LgKY - 3*LgP
LgKN = -1.442
|
x |
lgKn |
|
0,50 |
-1,495 |
|
X = 0,52 |
-1,442 |
|
0,60 |
-1,228 |
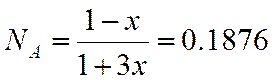 ;
; 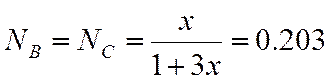 ;
;
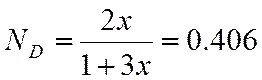
![]()
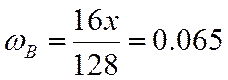 ;
; 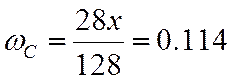 ;
;
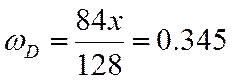
б) T=500 К
p=20 атм
С9H20 = СН4 + C2H4 + 2С3Н6
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.