|
lgKp(600) |
-26,485 |
2,005 |
-7,619 |
-9,638 |
|
Tкр |
583,9 |
190,55 |
282,6 |
364,9 |
|
Ркр |
23,2 |
45,41 |
50,5 |
46,6 |
|
Zкр |
0,27 |
0,27 |
0,27 |
0,27 |
|
π |
0,86 |
0,44 |
0,40 |
0,43 |
|
τ |
1,03 |
3,15 |
2,12 |
1,64 |
|
γ |
0,77 |
0,99 |
0,98 |
0,98 |
|
ω |
0,744 |
0,032 |
0,056 |
0,168 |
|
N= |
0,4210 |
0,145 |
0,145 |
0,289 |
Для С9H20
По графику γ=077.
Для СH4
По графику γ=0.99.
Для С2H2
По графику γ=0.98.
Для С3H6
По графику γ=0.98.
Kγ =1.26
lgKγ=0.1
LgKN=LgKf -LgKY - 3*LgP
LgKN = -2.408
|
x |
lgKn |
|
0,20 |
-2,709 |
|
X = 0,26 |
-2,408 |
|
0,30 |
-2,17 |
г) T=500 К
p=35 атм
С9H20 = СН4 + C2H4 + 2С3Н6
|
lgKp(600) |
-26,485 |
2,005 |
-7,619 |
-9,638 |
|
Tкр |
583,9 |
190,55 |
282,6 |
364,9 |
|
Ркр |
23,2 |
45,41 |
50,5 |
46,6 |
|
Zкр |
0,27 |
0,27 |
0,27 |
0,27 |
|
π |
1,51 |
0,77 |
0,69 |
0,75 |
|
τ |
1,03 |
3,15 |
2,12 |
1,64 |
|
γ |
0,58 |
0,99 |
0,98 |
0,95 |
|
ω |
0,856 |
0,018 |
0,031 |
0,094 |
|
N |
0,5980 |
0,101 |
0,101 |
0,201 |
Ky=2,043 lgKy=0,31
LgKN=-3,261
|
x |
lgKn |
|
0,10 |
-3,693 |
|
Х = 0,14 |
-3,261 |
|
0,20 |
-2,709 |
д) T=500 К
p=50 атм
С9H20 = СН4 + C2H4 + 2С3Н6
|
lgKp(600) |
-26,485 |
2,005 |
-7,619 |
-9,638 |
|
Tкр |
583,9 |
190,55 |
282,6 |
364,9 |
|
Ркр |
23,2 |
45,41 |
50,5 |
46,6 |
|
Zкр |
0,27 |
0,27 |
0,27 |
0,27 |
|
π |
2,16 |
1,10 |
0,99 |
1,07 |
|
τ |
1,03 |
3,15 |
2,12 |
1,64 |
|
γ |
0,47 |
0,99 |
0,97 |
0,94 |
|
ω |
0,906 |
0,012 |
0,021 |
0,062 |
|
N |
0,7057 |
0,074 |
0,074 |
0,147 |
Ky=2,043 lgKy=0,310
LgKN=LgKf-LgKY-3*LgP
LgKN=-3,812
|
x |
lgKn |
|
0,05 |
-4,761 |
|
Х =0,09 |
-3,812 |
|
0,10 |
-3,693 |
Получили
|
P, атм |
N С9H20, |
N СН4, |
N С2Н4, |
N С3Н6, |
|
1 |
0,0005 |
0,2499 |
0,2499 |
0,4997 |
|
10 |
0,188 |
0,2031 |
0,2031 |
0,4062 |
|
20 |
0,421 |
0,1447 |
0,1447 |
0,2895 |
|
35 |
0,598 |
0,1005 |
0,1005 |
0,2010 |
|
50 |
0,706 |
0,0736 |
0,0736 |
0,1472 |
|
P, атм |
ω С9H20, |
ω СН4, |
ω С2Н4, |
ω С3Н6, |
|
1 |
0,0021 |
0,1247 |
0,2183 |
0,655 |
|
10 |
0,4801 |
0,0650 |
0,1137 |
0,3412 |
|
20 |
0,7442 |
0,0320 |
0,0560 |
0,1679 |
|
35 |
0,8561 |
0,0180 |
0,0315 |
0,0944 |
|
50 |
0,9056 |
0,0118 |
0,0207 |
0,0620 |
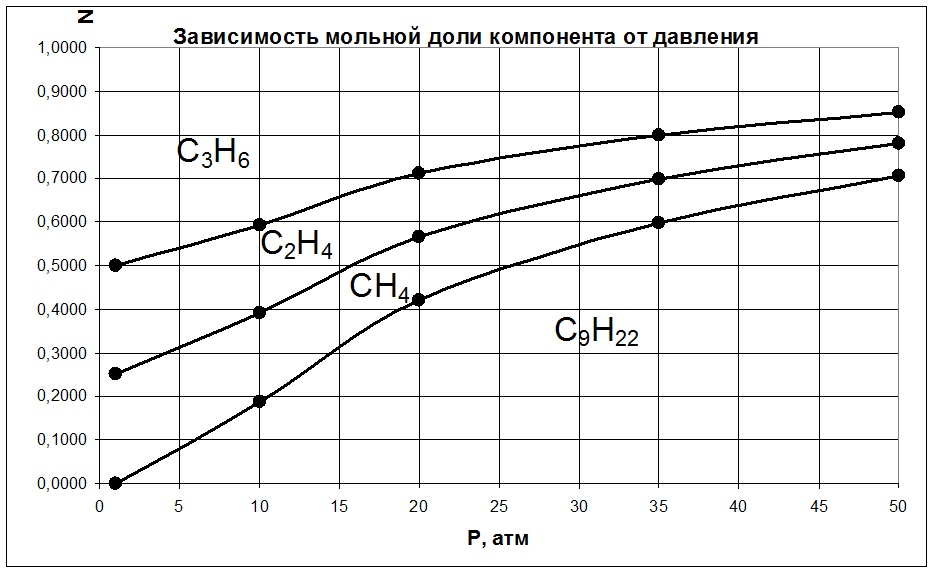
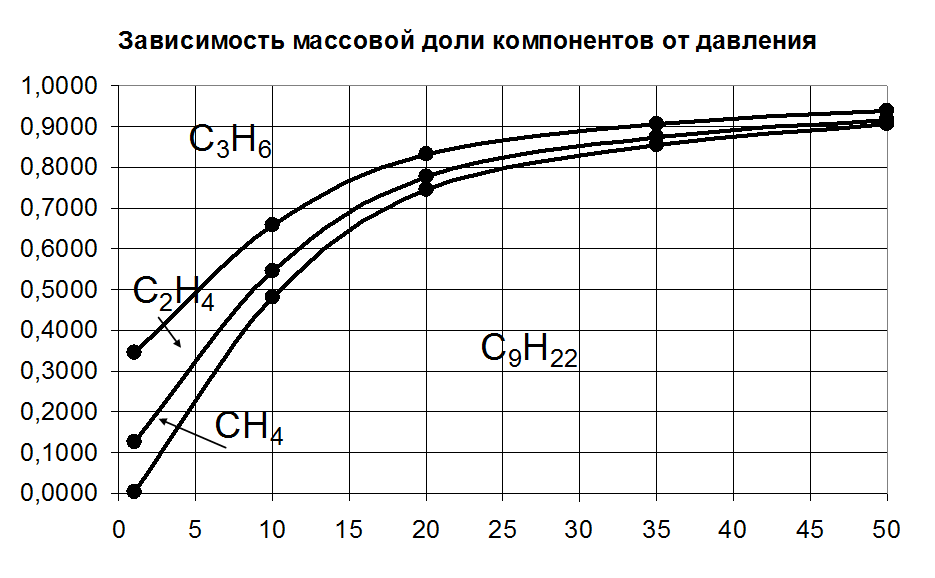
3. Вычислить тепловой эффект данной реакции при Т=500 К и давлении 50 атм.
С9H20 = СН4 + C2H4 + 2С3Н6
|
∆H1000 обр |
-62 |
-19,3 |
11,14 |
2,8 |
|
τ |
1,03 |
3,15 |
2,12 |
1,64 |
|
π |
2,16 |
1,10 |
0,99 |
1,07 |
|
Zкр |
0,27 |
0,27 |
0,27 |
0,27 |
|
Tкр |
583,9 |
190,55 |
282,6 |
364,9 |
|
(H0-H)/Tкр |
8,03 |
0,24 |
0,4 |
0,78 |
|
H0-H |
4688,7 |
45,732 |
113,0 |
284,6 |
(H0-H)/Tкр определяется по таблицам, в зависимости от τ, π, Zкр.
(H0-H)= (H0-H)/Tкр*Ткр
∆(H0-H) =2*284,6 +113,0 +45,732 – 4688,7= -3960,7кал
∆H5000 = 2*2,8 +11,14 -19,3 +62 = 59,44 ккал
∆H50050 =∆H5000 - ∆(H0-H) = 59,44 +3,96= 63,4 ккал
4. Анализ полученных результатов.
Согласно принципу Ле-Шателье равновесие реакции при повышении давления смещается в сторону уменьшения объёма. В реакции С9H20 = СН4 + С2H4 + 2С3Н6 вступает 1 мол веществ, образуется 4 моль. При повышении давления равновесие должно смещаться в сторону обратной реакции, в сторону образования
3-этил2-метилгексана – мольная доля исходного вещества растет, а продуктов уменьшается.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.