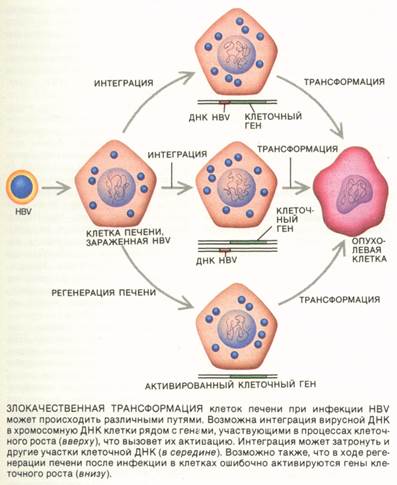
Вирус также может трансформировать клетку-хозяина в результате интеграции вирусной ДНК в хромосомную ДНК клетки. Внедрение вирусных последовательностей около клеточных онкогенов может нарушать экспрессию последних и быть причиной бесконтрольного роста. Это типично для ряда ретровирусов, вызывающих лейкозы и карциномы у млекопитающих и птиц после некоторого латентного периода. Хотя в процессе жизненного цикла HBV обычно его генетический материал не включается в геном хозяина, такие интегрированные формы могут случайно образовываться.К. Брешо, который работал одно время в нашей лаборатории, Д. Ша-фриц из Медицинского колледжа им. Альберта Эйнштейна и В. Раттер из Калифорнийского университета в Сан-Франциско анализировали ДНК из гепатом и обнаружили вирусные последовательности, интегрированные в хромосомы опухолевых клеток. Такие последовательности наблюдались в основном в опухолях у хронических носителей HBsAg, но встречались и у пациентов, не имевших HBsAg. Интегрированная вирусная ДНК также иногда обнаруживается в печени у хронических носителей HBV, а это свидетельствует о том, что интеграция может происходить до или на ранней стадии формирования опухоли.
АНАЛИЗ опухолей и клеточных линий показал, что ДНК HBV может включаться в клеточные хромосомы во многих разных местах. Это часто индуцирует различные генетические перестройки, такие, как делеции, транслокации и амплификации; подобные аномалии — общее явление для раковых заболеваний человека. Последствия этих генетических событий пока не вполне ясны.
В одном случае ранней гепатомы человека А. Дежан из нашей лаборатории обнаружила инсерцию ДНК НВ V в ген из семейства генов, кодирующих рецепторы стероидных гормонов и гормонов щитовидной железы. Этот ген удалось выделить, и оказалось, что его продуктом является рецептор ретиноевой кислоты. Ретино-евая кислота сильно влияет на диффе-ренцировку и пролиферацию клеток; с ее избытком на ранних стадиях беременности связаны некоторые врожденные дефекты. В культуре клеток это вещество может возвращать некоторые аномальные клетки в нормальное состояние, что используется при лечении лейкозов. Возможно, что мутация гена рецептора ретиноевой кислоты при интеграции в него ДНК HBV играет роль в генезисе гепатомы у человека.
В другом случае гепатомы человека Брешо (в настоящее время сотрудник Больницы Некер в Париже) обнаружил сходную интеграцию ДНК HBV в ген, кодирующий циклин А. Этот белок участвует в клеточном росте, и при ненормальной экспрессии его гена может нарушаться регуляция пролиферации клеток. О частоте таких вирусных инсерций в клеточный геном хотелось бы знать больше.
 Мы получили дополнительную информацию о роли
интеграции вирусной ДНК в развитии гепатомы, изучая опухоли лесных сурков, индуцированные видоспецифичным вирусом гепатита. В
этих опухолях вирусная ДНК всегда включается
в клеточный геном, причем в 30% случаев местом интеграции являются два
гена из семейства клеточных онкогенов туе. В норме эти гены участвуют в
регуляции клеточного роста и дифференци-ровки, но могут также иметь
отношение к развитию лимфоидных опухолей и различных карцином. Часть вирусного генома, содержащая энхан-сер, внедряется
около онкогена туе, не модифицируя сам ген. При этом синтезируются
нормальные белки Мус, но их
образование управляется вирусной
генетической информацией, а не клеточными механизмами. В результате клетка производит белки Мус в избытке, что ведет к бесконтрольному
клеточному росту. В принципе здесь
действует тот же механизм, что и при
ретровирусной индукции лимфоидных опухолей у грызунов и птиц.
Мы получили дополнительную информацию о роли
интеграции вирусной ДНК в развитии гепатомы, изучая опухоли лесных сурков, индуцированные видоспецифичным вирусом гепатита. В
этих опухолях вирусная ДНК всегда включается
в клеточный геном, причем в 30% случаев местом интеграции являются два
гена из семейства клеточных онкогенов туе. В норме эти гены участвуют в
регуляции клеточного роста и дифференци-ровки, но могут также иметь
отношение к развитию лимфоидных опухолей и различных карцином. Часть вирусного генома, содержащая энхан-сер, внедряется
около онкогена туе, не модифицируя сам ген. При этом синтезируются
нормальные белки Мус, но их
образование управляется вирусной
генетической информацией, а не клеточными механизмами. В результате клетка производит белки Мус в избытке, что ведет к бесконтрольному
клеточному росту. В принципе здесь
действует тот же механизм, что и при
ретровирусной индукции лимфоидных опухолей у грызунов и птиц.
Пока нет никаких указаний на то, что развитие гепатомы у человека имеет сходный механизм, и интенсивные исследования не обнаружили вызванных ДНК НВV инсерционных мутаций в онкогенах туе. Однако другие человеческие онкогены могут быть активированы прямо или косвенно ин-серцией ДНК HBV. П. Хофшнайдер из
Института им. Макса Планка в Мюнхене показал, что интегрированная ДНК HBV определяет синтез модифицированных белков, которые стимулируют экспрессию вирусных и кле-точчых генов, в том числе мощных онкогенов. О непрямом действии вируса сообщил Ф. Чизари из научно-исследовательского института Скриппсовской клиники: у трансгенных мышей сверхпроизводство большого белка оболочки HBV ведет к хроническому поражению клеток печени и в конце концов к геп атоме.
В экспериментах с переносом ДНК К. Мацубара из Университета в Осаке продемонстрировал активацию двух-клеточных онкогенов — гена lea , связанного только с гепатомой, и гена hst -7, участвующего в развитии рака желудка. В гепатомах человека наблюдались также другие генетические изменения, не так явно связанные с заражением HBV. Чтобы понять роль вируса в канцерогенезе на молекулярном уровне, необходимы дальнейшие исследования.
ОПИСАННЫЕ выше эксперименты показывают, как технология ре-комбинантных ДНК использовалась для понимания биологии HBV. Этот подход имеет также практическое применение — в разработке диагностических методов и вакцин. Диагностические тесты для гепатита В усовершенствованы при помощи метода молекулярной гибридизации, основанного на высоком сродстве коротких цепей клонированной ДНК к комплементарной ДНК. Клонированная меченая вирусная ДНК может служить чувствительным и надежным зондом для обнаруженя инфекционных вирусных частиц в сыворотке крови. В настоящее время молекулярная гибридизация с использованием ДНК НВV служит обычным методом для обнаружения заражения гепатитом В. Поскольку, определив в организме вирусную ДНК, можно оценить интенсивность репликации вируса, этот метод также имеет значение для дальнейшего прогресса антивирусной терапии.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.