Задача 12
Алюминий-магниевые сплавы готовят в печи
с магнезитовый футеровкой при температуре 1100 К. Алюминий может
взаимодействовать с материалом футеровки по реакции ![]()
Решение
∆G°р-ии = ∆G°Al2O3 - 3∙∆G°MgO = (-1685630 + 326,5∙1100) – 3∙(-728900 + 203,85 ∙1100) = -1326480 + 3∙504665 = 187515 Дж
lnK = - ∆G / RT = -187515 / 8,31∙1100 = -20,5 К = 10 -9
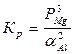
PMg = ![]() = 9,3∙10 -4
атм.
= 9,3∙10 -4
атм.
Задача 13
3(NaF) + Аl = 3Na(пар)+ (AIF3)
ΔG°NaF = - 623650 + 148,1·Т, ΔG°AlF3 = - 1228370 + 79,3·Т, Дж.
α NaF = 0,31; α AlF3 = 10-3
Рекшение
Вычислим изменение стандартной энергии Гиббса реакции при температуре 1223 К:
ΔGр-и = ΔGAlF3 - 3ΔGNaF = - 1228370 + 79,3·1223 – 3(- 623650 + 148,1·1223) = 196185 Дж/моль
Рассчитаем значение константы равновесия реакции:
lnK = ![]()
К = 4·10-9
Запишем выражение константы равновесия реакции и выразим отсюда РNa:
К = 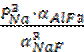
РNa = αNaF![]()
РNa = 0,31·![]() ·10-3 атм.
·10-3 атм.
Задача 14
T = 750 K.
![]()
Решение
Определим изменение стандартной энергии Гиббса
![]() – 131670 + 30,67 · 750 + 163020 –
87,95·750 = = – 11610 Дж/моль.
– 131670 + 30,67 · 750 + 163020 –
87,95·750 = = – 11610 Дж/моль.
Вычислим величину константы равновесия реакции
![]() K = 6.44
K = 6.44
Запишем выражение константы равновесия реакции
![]()
Найдем термодинамическую активность
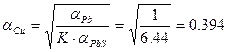
Определим мольную долю
D = b2 – 4ac, ![]() ,
, ![]() ,
,
D = 1 – 4 · 9.3 · 104 · (– 0 .394) = 146569
XCu = ![]()
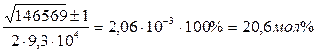
XPb = 1 – 0.00206 = 0.99794
Определим остаточную концентрацию меди в свинце
![]()
Задача 15
2(Cu2O) + {Cu2S} = 6[Cu] + SO2↑
T = 1500 K
Содержание меди Cu в черновой меди не превышает 95% мол.
Сульфидная фаза содержит 92,5% мол. Cu2S, а оксидная – 81,4% мол. Cu2O.
Определить давление сернистого газа (SO2), приняв термодинамические активности равными их мольной доле.
![]()
![]()
![]()
![]()
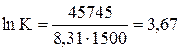
K = 39,25
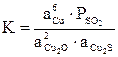
![]()
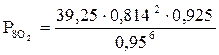
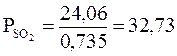 атм
атм
32,73 · 760 · 133,32 Па = 3,31 · 10-6 Па
Задача 16
Частично обожженные свинцовые концентраты подвергаются реакционной плавке с получением чернового свинца:
2(PbO)+[PbS]=3[Pb]+SO2
Решение:
![]() G0SO2=-361320+72,6*1450=-256050
Дж
G0SO2=-361320+72,6*1450=-256050
Дж
![]() G0PbS=-144210+72,1*1450=-39665
Дж
G0PbS=-144210+72,1*1450=-39665
Дж
![]() G0PbO=-180990+67,97*1450=-82433,5
Дж
G0PbO=-180990+67,97*1450=-82433,5
Дж
![]() G0=-256050+396665+2*82433,5=-51518
Дж
G0=-256050+396665+2*82433,5=-51518
Дж
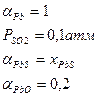
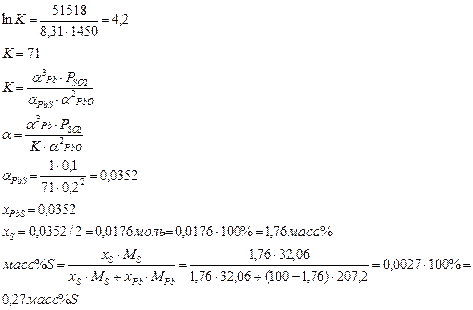
Задача 17
Сера может быть удалена из никеля путем введения магния при температуре 1800 К. Магний, интенсивно испаряясь (Ткип Mg = 1380 К), растворяется в никеле, где протекает реакция:
[Ni3S2] + 2[Mg] = 2MgS(тв) + 3[Ni]
Решение:
∆Gор-ии (1800) = 2∆GoMgS - ∆GoNi3S2 = 2∙(-715 520) + 2∙212,89∙1800 +362 920 - 172,83∙1800 = -1 431 040 + 766 404 + 362 920 - 311094 = - 612 810 Дж/моль
lnК = - ![]() =
= ![]() = 40,96
= 40,96
К = 6,2 ∙ 1017
К = 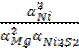
128 240,13
Ni + 2S = Ni3S2
0,002 m
Mr(Ni3S2) = 58,71∙3 + 64 = 240,13 г/моль
mNi3S2
= ![]() =
3,75∙10-3
=
3,75∙10-3
Х Ni3S2 = ![]() =
9,16∙10-6∙100% = 9,16∙10-4 мол % = αNi3S2(т.к. γNi3S2 = 1)
=
9,16∙10-6∙100% = 9,16∙10-4 мол % = αNi3S2(т.к. γNi3S2 = 1)
αMg =
![]()
ХMg = ![]()
Задача 18
[FeS]+CaC2(тв) = CaS(тв)+ 2[C] +[Fe]
∆G![]() =- 163860 +61,03T
=- 163860 +61,03T
∆G![]() =- 213600 +60,78T
=- 213600 +60,78T
∆G![]() =-701070 +190,77T
=-701070 +190,77T
∆G![]() =-701070+190,77*1880-(-213600+60,78*1880)-(-163860+61,03*1880)=-193965,2
Дж
=-701070+190,77*1880-(-213600+60,78*1880)-(-163860+61,03*1880)=-193965,2
Дж
lnK=-![]() =
=![]()
K=![]()
XC=![]()
XFe=1-0,01834=0,98166
lg![]() =-0,23+0,0898*0,01834=-0,1402
=-0,23+0,0898*0,01834=-0,1402
![]() =0,7241
=0,7241
![]()
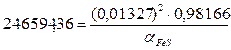
![]()
Задача 20
Одним из возможных способов получения черного никеля из сульфида никеля является его конвертирование при температуре 1800 К:
2[NiO] + 0,5 [Ni3S2 ] = 3,5 [Ni] + SO2 ↑
Решение
Вычислим изменение стандартной энергии Гиббса реакции при температуре 1800 К:
ΔG0 NiO = - 203 440 + 74,07 • 1800 = - 70114 Дж,
ΔG0 Ni3 S2 = - 362 920 + 172,83 • 1800 = - 51826 Дж,
ΔG0 SO2 = - 361 320 + 72,6 • 1800 = - 230640 Дж.
Определим ΔG0 реакции:
ΔG0 р = ΔG0 SO2 - 2ΔG0 NiO - 0,5 ΔG0 Ni3 S2 = - 230640 – 2 • (- 70114) - 0,5 • (-51826) =
= - 64499Дж
Рассчитаем значение константы равновесия реакции:
ln K = - ![]() = -
= - ![]() = 4,3120
= 4,3120
K = 74, 5895
Запишем выражение константы равновесия реакции:
K = 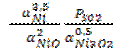 ; PSO2 = 1, α2NiO = 1.
; PSO2 = 1, α2NiO = 1.
K = ![]() , примим αNi = 1
, примим αNi = 1
![]() =
= ![]() , αNi3O2 =
, αNi3O2 = ![]() =
= ![]() = 0,00018
= 0,00018
αNi3O2 = 0,00018 • 100 % = 0,018 % мол.
Ответ: 0,018 % мол. Ni3S2
Задача 1
Алюминиевая промышленность использует карбонат лития как добавку к электролиту. Определить, протекает ли реакция диссоциации карбоната лития при температуре электролиза (960° С) по реакции
Li2CO 3=Li2O+CO2 , ΔG°=147960-78,8×T, Дж/моль
Решение
ΔG°1233=147960-78,8×1233=50799,6 Дж/моль
ΔG=ΔG°+RTlnpCO2
ΔG=50799,6+8,314×1233×ln0,0003=-32355Дж
Задача 2
Определить температуру начала разложения карбоната кальция по реакции
CaCO3 =CaO+CO2, ΔG°=170560-147,19×T, Дж/моль,
Решение
ΔG=0
ΔG=ΔG°+RTlnpCO2
1700560-147,19T+8,314×(ln0,12)×T=0
T=170560/164,8=1034K
Задача 3
Задача 4
Вторым продуктом производства кислородных станций является азот. Какое содержание кислорода в азоте должно быть, чтобы он мог быть использован в качестве защитной среды при горячей (800°С) прокатке меди?
Оксид меди разлагается по реакции
2Cu2O=4Cu+O2, ΔG°=337040-142,6×T, Дж/моль О2. Решение
ΔG=0
ΔG=ΔG°+RTlnpO2
ΔG=337040-142,6×1073=184030,2
lnpO2=-184030,2/8920,9=-20,6 pO2=10-9 атм.
Задача 5
Периклаз (MgO) получают путем разложения карбоната магния и последующего плавления MgO в дуговых электропечах. Определить температуру начала разложения карбоната магния на воздухе по реакции
MgCO3=MgO+CO2, ΔG°=110825-120,16, Дж
Содержание двуокиси углерода в атмосфере воздуха составляет 0,03%об.
Решение
ΔG=0
ΔG=ΔG°+RTlnpCO2
ΔG=110825-120,16T+8,314×ln0,0003×T
187,6T=110825 T=590K t=317°C
С + СО2 =2СО
При Т=1500К равновесие реакц сильно смещено вправо:
Константа равновесия:
Выражение константы равновесия:
В воздухе содержится 21% об. Кислорода; сгорая, он образует газы СО И СО2. Т.к. реакция смещена вправо, то образуется в основном газ СО. Вместо одного моля кислорода в газовой фазе образуется два моля СО: С+О2=2СО, т.е. 21% об. Кислорода в воздухе заменится на 425 об.СО. При общем давлении газов в системе 1 атм суммарное давление газов СО и СО2 составляет 42\121=0,347 атм.
Определим парц давление газа СО:
Свободный кислород в системе будет являться продуктом диссоциации высшего оксида углерода:
Опред константу равнов:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.