Вообще аморфный кварц SiO2 - одно из неорганических соединений, к которому впервые был применен метод Фурье-анализа кривых интенсивностей рассеяния рентгеновских лучей. Проверялась гипотеза Захариасена о том, что структуру аморфного SiO2 можно имитировать моделью беспорядочной сетки, в которой каждый атом кремния находится в центре тетраэдра, в углах которого находятся атомы кислорода. Б.Уоррен проанализировал кривые интенсивности рассеяния на основе представления о существовании пар атомов Si-O (рис.1.8.4), она представляет собой суперпозицию кривых распределения вокруг атома Si и атома О.
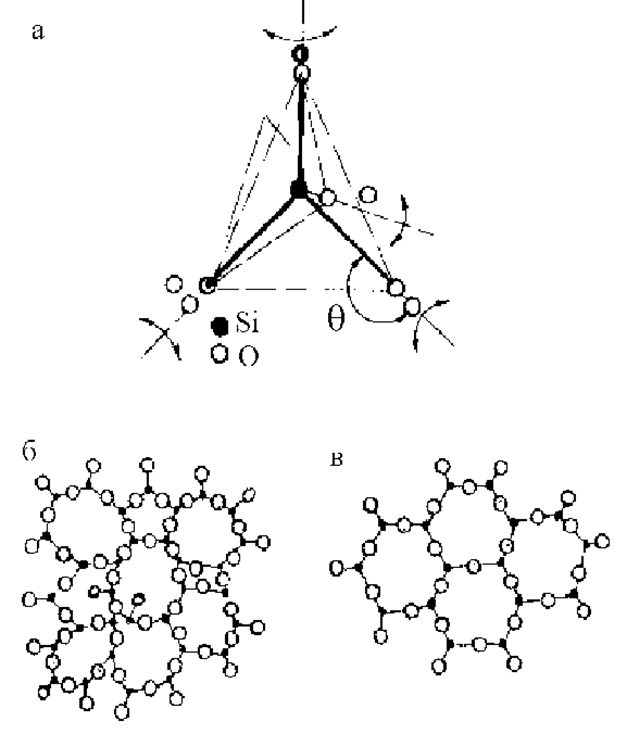 |
Рис. 1.8.5. Структура аморфного кремнезема SiO2: а - элементарный тетраэдр, б - плоское изображение неупорядоченной сетки, в - проекция на плоскость схемы структуры кристаллического SiO2
Выводы из этого исследования были следующими. Рентгеновские данные полностью объясняются, если представить себе структуру аморфного кремнезема в виде неправильной сетки, состоящей из элементов, где каждый атом кремния находится в тетраэдрическом окружении четырех атомов кислорода, а каждый атом кислорода связан с двумя атомами кремния (рис. 1.8.5). Вокруг направлений Si-O (показаны пунктиром на рис. 1.8.5,а) ориентация тетраэдров беспорядочная и никаких пространственно протяженных плоскостей с высокой плотностью атомов не наблюдается. Атомы кислорода выполняют функцию "мостиковой" связки между тетраэдрами.
Первый максимум кривой (см. рис.1.8.4) соответствует расстоянию R1= 1,62 Å и согласуется с длиной связи Si-O в кристаллическом кварце. Второй максимум при R2 = 2,65 Å соответствует расстоянию О-O. Положение третьего максимума R3 = 3,12 Å определяет расстояние Si-Si. Эти данные позволяют утверждать, что связи Si-O-Si не лежат на одной прямой. Угол q (рис.1.8,5,а) изменяется от 120° до 180°, с максимумом при 144°. Этот большой интервал возможных изменений угла и отличает аморфный кварц от кристаллического. В кристалле все тетраэдры расположены в нескольких идентичных позициях, под одними и теми же углами, сохраняя плоскость симметрии.
О полной разупорядоченности ориентаций тетраэдров вокруг направления связей Si-O свидетельствуют положения 4-го максимума (расстояния кремний - второй кислород), 5-го максимума (кремний - второй кремний и кислород - второй кислород).
Аналогичное исследование борокислородного стекла B2O3 привело к выводу, что каждый атом бора окружен тремя атомами кислорода. Структура в целом представляет собой сетку из борокислородных групп B3O6, образующих шестиугольник из трех атомов бора и трех атомов кислорода, три атома кислорода вне этого шестиугольника связаны как с атомами бора данного кольца, так и с атомами следующего шестиугольника (выполняют функцию "мостика"). Предложенная структура с основным элементом BO3 объясняет не только экспериментально наблюдаемые длины межатомных связей и координационные числа, но и трудность получения кристаллического B2O3 из стекла.
В ряде исследований с использованием методов оптической ИК-спектроскопии и рентгеновской дифрактометрии установлено, что размытые дифракционные максимумы интенсивности в аморфных телах по своему расположению совпадают с острыми максимумами, характерными для кристаллического состояния того же вещества. Если, следуя А.А.Лебедеву, сделать предположение о наличии микрокристаллической структуры с поперечным размером 15-20Å, т.е. структуры, состоящей из кристаллов, каждый из которых содержит 4-10 правильных элементарных ячеек, то расчетные кривые ФРР и экспериментальные хорошо совпадают.
О немонотонности, микрогетерогенности структуры стекла свидетельствуют и малоугловая рентгеновская дифракция, электронная микроскопия. Микронеоднородности обнаружены в широко распространенных щелочно-силикатных стеклах (Е.А.Порай-Кошиц, Фогель и др.), в структуре натриево-боросиликатных стекол. В ряде случаев она выражена столь сильно, что стекло правильнее рассматривать как микрорасслаивающуюся систему, что уже не укладывается в рамки кристаллической гипотезы.
Особый класс веществ, ситаллы, как показывают расчеты дифракционных данных, в простейшем случае представляют собой систему хаотично ориентированных кристалликов с характерным поперечным размером около 1 мкм, связанных друг с другом прослойками аморфной структуры. Соотношение между образовавшейся кристаллической фазой и остаточной стекловидной фазой, мало отличающимися по химическому составу, различно, но минимальное количество аморфной фазы составляет 10-15%. Основой технологии получения ситаллов с заданным комплексом свойств должны служить знания о микроликвации вводимого катализатора направленной кристаллизации. Эти сведения могут быть получены прецизионными измерениями распределения химических элементов в объеме.
Элементы IV группы - С, Si, Ge, а также халькогениды -Se, Te, Sb, соединения с As, Р, B - сравнительно легко аморфизируются. В частности, бывает достаточно переохлаждения в процессе осаждения из паровой фазы в вакууме на охлаждаемую подложку. Особенностью халькогенидных аморфных соединений является наличие в их структурах участков в виде гофрированных или изогнутых слоев, например, в соединениях GeSe, GeTe (функция распределения этого вещества приведена на рис.1.4.2), As2Те3, As2Se3, As2S3. Параметры цепочечно-слоевой структуры и влияние на нее добавок металлов Ag, Cu Hg, исследовались с помощью кривых интенсивности рассеяния и функций радиального распределения электронной плотности.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.