1. Превращения в первой координационной сфере. В этом случае расположение ближайших соседей полностью нарушается и возникает новый тип решетки. Это превращение может идти с деформациями (растяжения - сжатия) и реконструктивно (с перестройками). Например, решетка CsCl (ОЦК, координационное число К1 = 8) при 4450C перестраивается в решетку типа NaCl (ГЦК, координационное число К1 = 6 по одноименным ионам) деформационным путем, благодаря вытягиванию вдоль направления [111]. Этот процесс происходит быстро. При реконструктивном превращении в CaCO3 арагонитÛ кальцит (координационные числа 9 и 6 соответственно) должны происходить промежуточные перестройки атомов, и поэтому этот процесс идет медленно и требует значительной энергии.
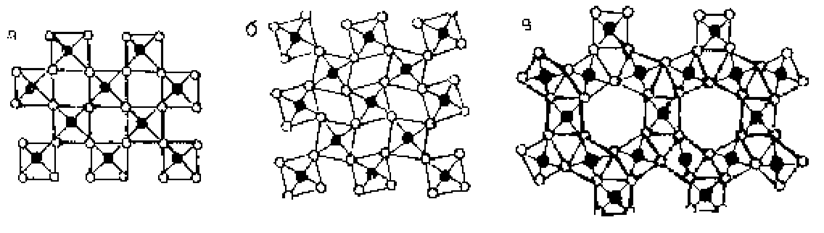 |
Рис. 1.7.3. Полиморфные превращения во второй координационной сфере: а - исходная структура; б - структура перестройки с низкой энергией активации (например, a-кварц Þ b-кварц); в - структура перестройки с высокой энергией активации (например, сфалерит Þ вюрцит для ZnS)
Но расположение дальних соседей изменяется. Вновь различают превращения со смещением (рис.1.7.3,а,б) и реконструктивные (см.рис.1.7.3,а,в). Сдвиг атомов без разрыва связей осуществляется быстро, а реконструкция с разрывом межатомных связей и перемещением требует преодоления существенного потенциального барьера и происходит медленнее.
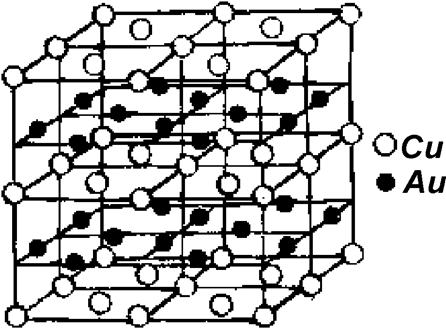
3. Превращения с разупорядочением (обратимый переход порядок - беспорядок) могут происходить как путем вращения определенных атомных группировок (например, молекул СН4 в отвержденном метане) - быстрый процесс, так и статистическим перераспределением атомов по эквивалентным местам решетки - медленный процесс. Второй способ перестройки широко распространен в металлах при высоких температурах. Так, в гранецентрированной кубической решетке CuAu при t< 408оC структуру представляют в виде четко чередующихся слоев атомов Сu и Au - сверхструктура (рис.1.7.4). При нагревании выше 408°С и выдержке образуется смешанный кристалл, в котором позиции в центре граней атомы Cu и Au занимают статистически. Поскольку процесс перемещения - диффузионный, то скорость его невелика.
 Разупорядоченное состояние можно
"заморозить", если быстро охладить вещество.
Разупорядоченное состояние можно
"заморозить", если быстро охладить вещество.
Рис. 1.7.4. Сверхструктура сплава CuAu
4. Превращение с изменением типа межатомной связи. Классическим примером является переход алмаз - графит. Графит является термодинамически более стабильной фазой. При переходе алмаз Þ графит часть чисто гомеополярных s-связей превращается в p-связи, являющиеся по сути металлическими. Олово при t<18°С переходит в неметаллическую модификацию серого олова, а выше этой температуры Sn – белое олово с ясно выраженными металлическими связями. Превращения этого типа также протекают медленно.
В ряде случаев наблюдаются и комбинированные превращения, когда одновременно изменяются координационные числа, степень упорядоченности и характер связи.
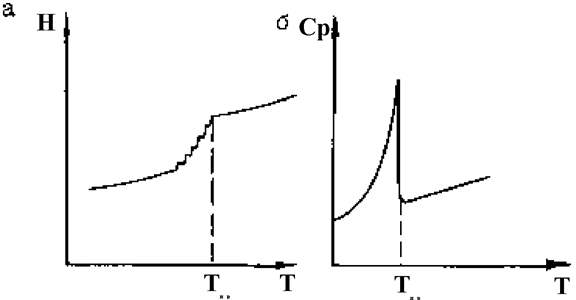
Термодинамика существования и превращения фаз кратко рассматривалась выше (см. рис.1.7.2, где представлена диаграмма фазовых переходов первого ряда с изменением агрегатного состояния вещества). Полиморфные превращения в конденсированном состоянии - фазовые переходы второго ряда. В этом случае энтальпия Н как функция температуры не изменяется скачкообразно, а увеличивается постепенно (рис.1.7.5,а), зато скачкообразно изменяется кривая молярной теплоемкости Сp (рис.1.7.5,б).
Последнее обстоятельство является физическим обоснованием калориметрического метода построения фазовых диаграмм и определения температур фазовых переходов.
 |
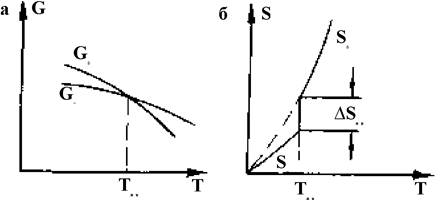 |
Рис. 1.7.6. Изменение свободной энергии G (а) и энтропии S (б) при полиморфном превращении
Энтропия обеих модификаций в точке превращения различна. Энтропия высокотемпературной модификации Sb больше энтропии низкотемпературной модификации Sa на величину DS энтропии превращения, которая может быть найдена, если определить величину DQпр (теплоту превращения):
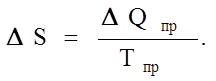 (1.7.9)
(1.7.9)
Положительное изменение S с увеличением температуры следует из соотношения (1.7.3)
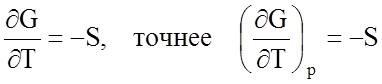
Поскольку для точки перехода Ga =Gb и
Ga = Ha - Tпр×Sa, a Gb = Hb - Tпр×Sb,
то можно найти энтальпию превращения Нпр:
Hпр = DH = Hb - Ha = Tпр(Sb - Sa) = Tпр×DS. (1.7.10)
Таким образом, так как Sb>Sa, энтальпия превращения Нпр всегда положительна, если рассматривается полиморфный переход, происходящий вследствие нагревания. Величины DH, DS, DG являются основными термодинамическими характеристиками веществ и приводятся в справочниках физических, физико-химических и химических величин.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.