 |
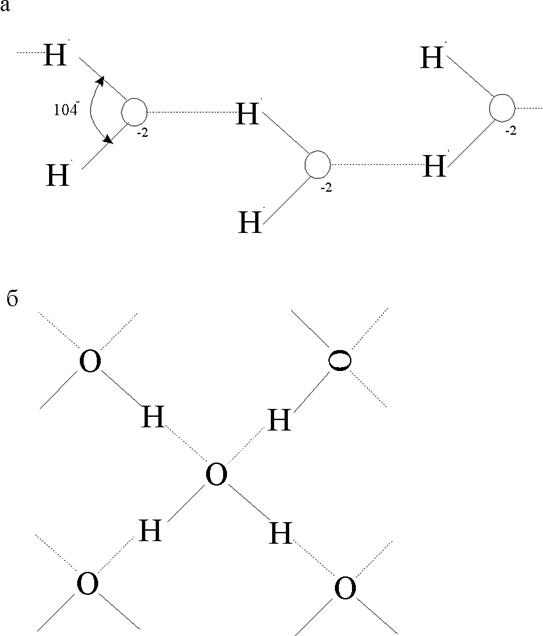
Рис.1.3.6. Механизм возникновения связи водородного типа между молекулами воды (а) и льда (б)образование кристаллов..
Поскольку никаких обменных межмолекулярных процессов при этом не происходит, то водородную связь нельзя считать каким-то особым видом взаимодействия. Она является промежуточной комбинацией межмолекулярной связи ван-дер-ваальсовского типа и ионной связи. Она рассмотрена отдельно, поскольку величина ее довольно заметна - порядка
0,5 эВ на молекулу, что соответствует Uc=20¸40 кДж/моль; кроме того, именно она определяет многие биологические процессы, без воды биологическая жизнь невозможна. Механизм возникновения связи между молекулами воды поясняет рис.1.3.6.
Молекула воды имеет значительный дипольный момент, причем расстояние между ионами О-2 и Н+1 внутри молекулы составляет »0,92Å. Электрическое поле любой выделенной молекулы ориентирует соседние молекулы-диполи так, что ион кислорода одной молекулы, кроме жесткого удерживания собственных ионов водорода, притягивает еще и водородные ионы соседних молекул.
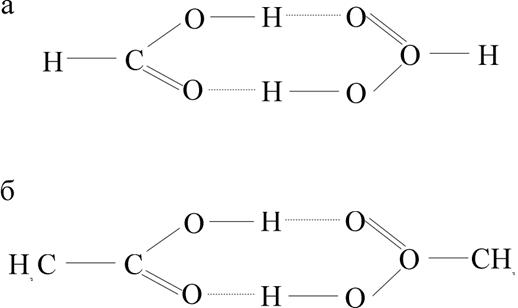 |
Рис. 1.3.7. Схема образования димерных структур за счет водородных связей: муравьиная HCOOH (а) и уксусная CH3COOH (б) кислоты
Из рис. 1.3.6,б видно, что каждый ион кислорода находится в окружении ионов водорода, образующих конфигурацию неравнобокого тетраэдра. Расчет показывает, что система имеет минимум потенциальной энергии, если межмолекулярное расстояние rOH = 2,76Å, что примерно в три раза больше, чем длина связи внутри молекулы. Эффективная величина заряда, участвующего в межмолекулярной связи ионного типа, составляет ±0,19е.
Обрывом "длинных" связей в процессе нагрева вода объясняют, в частности, увеличение ее плотности при нагреве в интервале от 0 до 40С, далее превалирует термическое расширение, связанное с возрастанием кинетической энергии молекул. Установление водородных связей приводит к заметному увеличению объема воды при кристаллизации в лед.
Наличием водородной связи объясняют возникновения устойчивых димеров некоторых органических кислот, спиртов и других соединений, имеющих активные группы, содержащие водород. На рис. 1.3.7 представлены схемы образования димеров.
Важная роль водорода подчеркивается тем обстоятельством, что замена водорода в этих соединениях другими атомами или группами исключает полимеризацию. К этому же классу веществ относятся ионы гидрофторида (HF2-), дигидрофосфат калия (KH2PO4) и дезоксирибонуклеиновая кислота ДНК - носитель генетической информации всех форм жизни.
Иногда водородную связь называют также связью с водородными мостиками.
Этот тип связи является наиболее универсальным, так как осуществляется при сближении электронейтральных атомов и молекул без отрыва от них электронов. Однако по величине это наиболее слабая связь с величиной порядка Uc = 10 Дж/моль. В курсе общей физики силы Ван-дер-Ваальса были введены для описания состояния реального газа при значительных плотностях. Для одного моля реального газа это уравнение имеет вид:
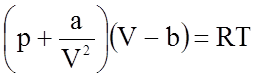 , (1.3.6)
, (1.3.6)
где p,V, Т - параметры состояния газа, a/V2 - поправка, учитывающая действие сил притяжения, b - поправка, называемая собственным объемом молекул, которая учитывает действие сил отталкивания по мере неограниченного сближения молекул.
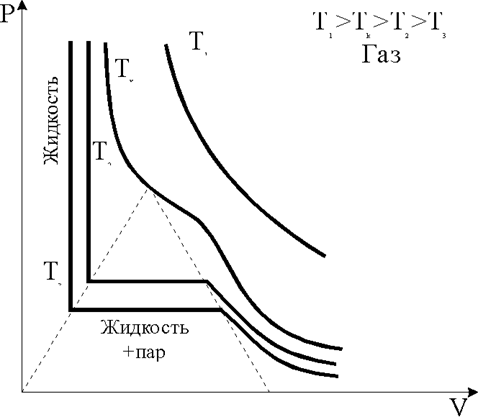
Как следует из фазовой диаграммы газ-жидкость (рис. 1.3.8), увеличение давления при температуре Т<Тк приводит к превращению части газа в жидкость, при еще более низких температурах жидкость затвердевает. В настоящее время твердое состояние достигнуто для всех химических элементов.
 |
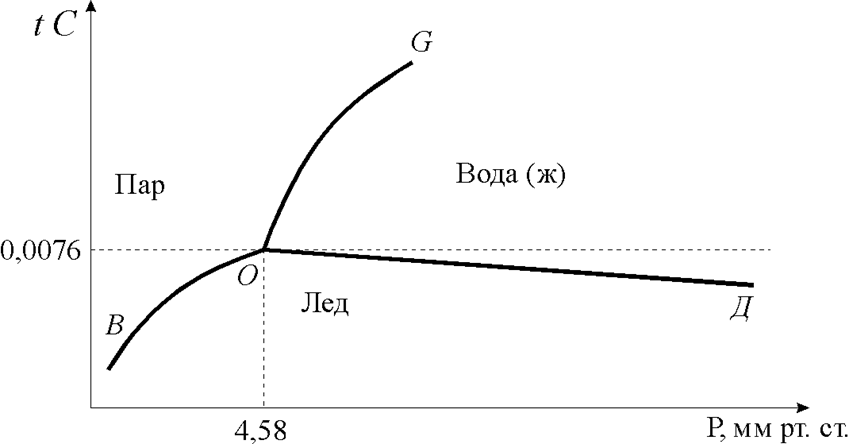
В качестве примера на рис.1.3.9 приведена фазовая диаграмма для воды: 0 - тройная точка сосуществования всех агрегатных состояний, ВО - линия состояния равновесия льда с паром, ОД - жидкой воды с паром.
Силы Ван-дер-Ваальса происходят от имеющегося или наведенного (индуцированного) дипольного взаимодействия нейтральных молекул, поэтому эти связи называют еще межмолекулярными. Эти силы играют определяющую роль в существовании жидкого и твердого состояния веществ, состоящих из молекул с насыщенными и прочными внутримолекулярными связями - Не, Ne, Ar, Н2, N2, О2, CCl4, СО2, CH4 и т.п.
В общем случае молекулярная связь обеспечивается тремя типами взаимодействий (дисперсионным, ориентационным, индукционным) и описывается для пары молекул потенциалом Леннарда-Джонса (1.3.7).
 |
Поскольку энергия отталкивания очень быстро - пропорционально г–12 - убывает с расстоянием, то при рассмотрении обычно учитываются лишь силы притяжения. Энергия притяжения приближенно равна
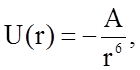
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.