 |
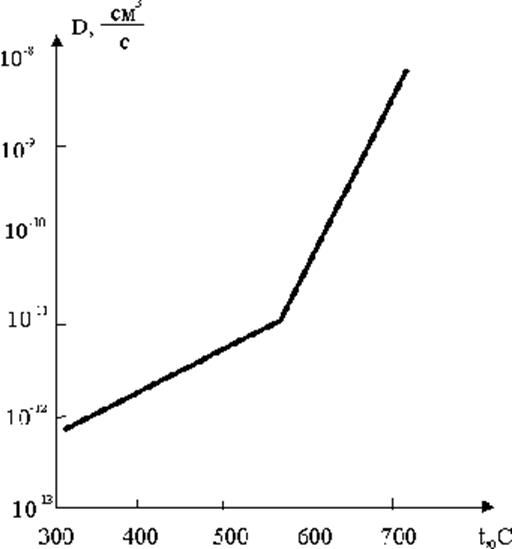
Рис.2.2.19. Температурная зависимость коэффициента диффузии Na+ в решетке NaCl
В области низких температур, ниже точки перегиба (см. рис. 2.2.19), значение коэффициента диффузии оказывается зависящим от наличия примесей в образцах и от степени дефектности структуры, связанной с предшествующей обработкой образцов. Это проявляется как разброс экспериментальных точек, полученных разными авторами и в несоответствии данных, полученных прямым методом меченых атомов и из опытов по электропроводности. Количество вакансий в кристаллах, как известно, экспоненциально зависит от температуры, так что процесс диффузии в NaCl при высоких температурах контролируется процессом рождения вакансий преимущественно катионного типа с энергией активации DЕ и процессом движения вакансий с энергией активации U, так что коэффициент собственной диффузии будет определяться уравнением
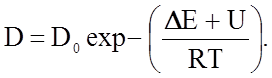 (2.2.63)
(2.2.63)
В области низких температур концентрация дефектов слабо зависит от температуры, и коэффициент диффузии определяется из известного выражения (2.2.61), но уже нельзя пренебречь влиянием на процесс диффузии других несовершенств структуры - дислокаций, межблочных и межзеренных границ, служащих источниками и стоками вакансий и дислоцированных ионов. В кристаллах NaCl дислоцированные ионы – это катионы Na+, имеющие существенно меньший размер по сравнению с ионами Сl - и потому значительно меньшую энергию активации процесса движения в решетке.
Значительно менее удовлетворительное положение с теорией диффузии в окислах.
Скорость диффузии контролируется во всех случаях числом ионов, способных перемещаться, и их подвижностью. Как энергия образования дефектов, так и энергия активации их перемещения в окислах выше, чем в галогенидах, поэтому и зависимость скорости диффузии от температуры у окислов сильнее. В высокотемпературной области собственной диффузии величина энергии активации колеблется в интервале от 3 до 6 эВ, а в низкотемпературной структурочувствительной области оказывается близкой 1,5 эВ для различных оксидных систем (против 1,8 эВ и 0,77 эВ для диффузии Cl – и Na+ в NaCl, соответственно). Еще более велико влияние температуры на диффузию в ковалентных соединениях, часто применяемых в качестве огнеупорных. Например, энергия активации самодиффузии в графите по данным прямых измерений достигает 7 эВ, что в среднем почти в два раза выше, чем при диффузии катионов в окислах. Очень медленно протекает диффузия и в ковалентных нитридах и карбидах.
Диффузия протекает по-разному в окислах стехиометрического состава и нестехиометрических, так как во втором случае необходимо учитывать наличие заметной концентрации точечных дефектов кристаллической решетки по сравнению с равновесной концентрацией в решетках окислов стехиометрического состава. Очень велико также влияние примесей, что приводит к трудности выделения области собственной диффузия, по крайней мере, резкие перегибы на температурной зависимости D = f(T), как правило, не наблюдаются. Возможно, эти точки лежат при более высоких температурах (в силу высокой температуры, обеспечивающей активацию процесса рождения дефектов, по Френкелю или Шоттки). На рис.2.2.20 приведены сводные данные (по У.Д.Кингери) о диффузии в различных оксидных системах. Для сравнения приведен график и для диффузии Na+ в NaCl.
Анализ данных рис.2.2.20 свидетельствует, во-первых, о более высокой скорости диффузии в нестехиометрических окислах. Так, в кристаллической решетке вюстита, формула которого Fe1-xО (подобным образом может быть записана формула для закиси кобальта) заметная диффузия ионов Fe+2 железа наблюдается уже в диапазоне температур 600...800oC .
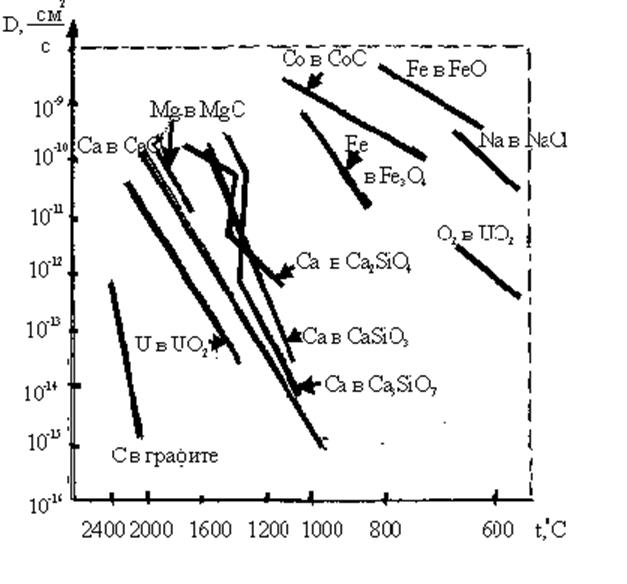 |
Рис. 2.2.20. Коэффициенты диффузии в зависимости от температуры для некоторых кристаллов
Во-вторых, диффузия в окислах может осуществляться движением как катионов, так и анионов. Например, в окиси урана со структурой типа флюорита уже при t ~ 600°С наблюдается (сравнительно небольшая) диффузия ионов O-2 , в то время как диффузия катионов урана становится заметной лишь при t > 1500°С. Обнаружено, что диффузия ионов кислорода осуществляется эстафетным механизмом с энергией активации около 117 кДж/моль = 1,2 эВ/ион, т.е. соответствует области низкотемпературной диффузии.
Коэффициенты диффузии катионов в окислах однозначно охарактеризовать более трудно, однако можно предположить, что вследствие высоких значений энергии активации диффузии в таких окислах, как MgO, CaO, данные для которых приведены на рис. 2.20, в этих материалах при высоких температурах происходит собственная диффузия, не зависящая от небольшого количества примесей.
Структура стекол характеризуется сравнительно низкой плотностью и наличием микропустот, в которых размещаются щелочные и щелочноземельные ионы. При этих условиях наблюдается довольно быстрая их диффузия.
Например, коэффициент диффузии натрия в натрийсиликатном стекле возрастает по почти линейному закону от ~5×10-10 см2/с при 400°С до ~5×10-6 см2/с при 1000°С, причем энергия диффузии в стекле оказывается отрицательной. В то же время очень мала подвижность ионов остова, в частности ионов кремния в силикатных структурах.
Очень интересны и важны в практическом отношении данные о диффузии в расплавах ионных соединений и стекол. Обычно эти данные получают на основе измерения электросопротивления и чисел переноса si как доли тока, переносимого частицами i-го сорта. В жидкой фазе оказывается возможной диффузия групп атомов, например SiO2. Было показано, что подвижность щелочных ионов в силикатных расплавах по крайней мере на порядок выше подвижности других ионов. В качестве типичного значения коэффициентов диффузии в этом случае можно указать D»10-4 см2/с для диффузии ионов в расплавах таких солей, как NaCl и NaNO3 в точке их плавления. Полагают, что наполовину диффузия в расплавах осуществляется за счет перемещения в целом электронейтральных пар связанных между собой ионов или, что то же самое, связанных пар вакансий (бивакансий).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.