В комплексе свойств твердых тел (электро- и теплопроводность, теплоемкость, оптические и магнитные свойства), определяющую роль играет не только ионный остов решетки, но и энергетическое состояние электронов внешних оболочек атомов, объединенных в кристалл или аморфный конгломерат. Нужно отдавать себе отчет в том, что попытки точных расчетов поведения отдельных электронов бессмысленны. Квантово-механический принцип неопределенностей запрещает попытки вычисления точных траекторий или орбит электронов уже в отдельных атомах и молекулах. Поскольку макроскопическое тело массой 1 г содержит около 1023 атомов, то следовало бы ожидать, что и трудность задачи возрастет во столько же раз в сравнении с задачами для отдельных молекул. Однако в действительности это не так и, как это ни удивительно, многие решения для кристаллических структур являются даже более простыми и точными, чем для сложных молекул. Причина этого лежит в периодичности кристаллической структуры и, следовательно, силовых полей, воздействующих на электроны, ионы, заряженные дефекты, а также в достаточной протяженности структуры, зачастую позволяющей рассматривать ее как бесконечно протяженную.
Известная модель свободных электронов в металлах, наряду с качественно верными ответами об электро- и теплопроводности, о термоэлектронной эмиссии, о некоторых контактных и термоэлектрических явлениях, - оказывается совершенно бессильной при описании свойств полупроводников и диэлектриков, и зачастую не может дать ответ на некоторые вопросы о важнейших свойствах: почему у различных твердых тел при близких параметрах прочности, пластичности, плотности столь поразительно могут отличаться электрические свойства - удельное электросопротивление колеблется от »1014 Ом×м у хороших диэлектриков до »10-8 Ом×м у проводников? Почему у тех же веществ так мало отличается теплоемкость? Почему столь различно изменяется с температурой электропроводность у металлов и полупроводников? Почему у некоторых веществ при низких температурах проявляется сверхпроводимость?
Очень продуктивной во многих отношениях оказалась зонная теория электронного строения твердых тел.
Строгие аналитические решения даже для одного электрона в поле более чем двух силовых центров-ядер или ионов - до сих пор не получены в силу больших математических трудностей. Приближенные решения, достигнутые довольно сложными методами теории возмущений, дали некоторые важные ответы о деталях поведения электронов в молекулах. Здесь мы проведем качественное обсуждение ожидаемого возможного существования и расположения энергетических электронных уровней. Принципы и пути, используемые при точных решениях, будут рассмотрены в п.4.2.
Известно,
что в изолированных атомах состояние всех электронов однозначно описывается
четырьмя квантовыми числами: n - главным, l - орбитальным, m - магнитным и s - спиновым. Главное квантовое
число n характеризуется целочисленными
значениями n = = 1,2,3,...,![]() для невозбужденных атомов,
определяет номер и энергию стационарного состояния атома. В частности, в
простейшем атоме водорода набор разрешенных энергетических уровней (термов)
определяется соотношением
для невозбужденных атомов,
определяет номер и энергию стационарного состояния атома. В частности, в
простейшем атоме водорода набор разрешенных энергетических уровней (термов)
определяется соотношением
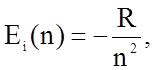 (1.4.1)
(1.4.1)
где
R = 13,6 эВ- универсальная постоянная Ридберга, n = 1,2,3,...,![]() .
.
В изолированном атоме водорода занятым оказывается лишь одно состояние из этого набора; состояния, соответствующие дробным значениям n, запрещены.
Орбитальное
квантовое число l принимает значения l=0,1,2,3,..., (n - 1) - всего n значений - и определяет
механический орбитальный момент количества движения (момент импульса) электрона
![]() .
Величина момента импульса
.
Величина момента импульса ![]() в
состоянии, характеризуемом значением квантового числа l, может быть найдена из соотношения
в
состоянии, характеризуемом значением квантового числа l, может быть найдена из соотношения
![]() (1.4.2)
(1.4.2)
где
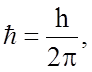 h
= 6,62×10-34 Дж×с -
постоянная Планка.
h
= 6,62×10-34 Дж×с -
постоянная Планка.
Магнитное
квантовое число m принимает целочисленные значения
из ряда ml = -l,-l+1,...,-1, 0, 1,..., l-2, l-1, l и определяет ориентацию
вектора орбитального момента ![]() относительно
направления в пространстве, выделенного внешним магнитным полем
относительно
направления в пространстве, выделенного внешним магнитным полем ![]() . Вектор
. Вектор ![]() e может ориентироваться относительно
направления
e может ориентироваться относительно
направления ![]() лишь так (рис. 1.4.1), что его
проекция подчиняется соотношению
лишь так (рис. 1.4.1), что его
проекция подчиняется соотношению
![]() (1.4.3)
(1.4.3)
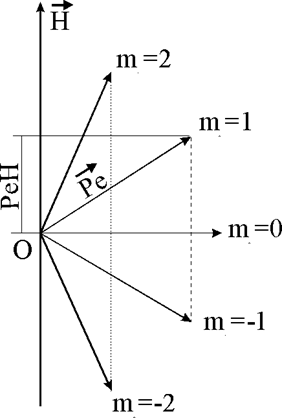 Рис.1.4.1. Возможные ориентации вектора орбитального
момента электрона относительно напряженности внешнего магнитного поля Н
Рис.1.4.1. Возможные ориентации вектора орбитального
момента электрона относительно напряженности внешнего магнитного поля Н
Всего при данном значении l возможно
(2 l + 1) значений ml
(и ориентаций вектора ![]() ).
).
 Спиновое квантовое число s
может принимать лишь два значения (s = +1/2 или s
= -1/2) и определяет ориентацию относительно того же направления
Спиновое квантовое число s
может принимать лишь два значения (s = +1/2 или s
= -1/2) и определяет ориентацию относительно того же направления ![]() собственного (или спинового) момента
количества движения
собственного (или спинового) момента
количества движения ![]() электрона.
электрона.
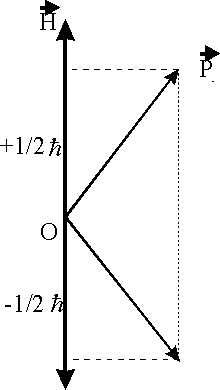
Рис.1.4.2. Возможные значения спина относительно направления, выделенного Н
Как
видно из рис.1.4.2, возможны лишь два варианта ориентации ![]() относительно
относительно
![]() , при этом величина проекции составляет
, при этом величина проекции составляет
![]() (1.4.4)
(1.4.4)
Состояния электронов, у которых орбитальное квантовое число l=0, называются s - состояниями. В каждом атоме число s – состояний определяется числом n , поэтому соответствующие состояния и электроны называют 1s , 2s , 3s и т.д. состояниями (электронами). Состояния и электроны с l = 1 называют р-состояниями и электронами, l = 2 называют d - состояниями и электронами. Далее используются индексы f , g и h .
В многоэлектронных атомах формула 1.4.1 не применима, так как возможные значения энергии зависят не только от главного квантового числа n , но и от орбитального l: Е = Е( n , l), причем n и l принимают взаимосвязанные дискретные целочисленные значения, что соответствует возможным наборам дискретных значений энергии Е(n,l). Например, при n = 1, т.е. Е=Е(1,0) (К-оболочка), возможны лишь значения l = 0, ml= 0, s = ± 1/2 - всего возможно максимум одно 1s - энергетическое состояние с двумя 1s - электронами.
 |
Рис. 1.4.3. Энергетические уровни и их заполнение в невозбужденном изолированном атоме Na (условный масштаб по оси энергий)
Всего у атомов с n = 2 возможны 5 значений энергии - два различных s - состояния и три р-состояния (последние - с одинаковым значением энергии). Все уровни s принято называть невырожденными, т.к. каждому из них соответствует единственное энергетическое состояние электрона в атоме, в котором, в соответствии с принципом Паули, могут находиться максимум два электрона с различными спинами. Все остальные уровни - р, d, f и т.д. называют вырожденными, так как каждому из них отвечает не одно, а несколько разрешенных электронных состояний. В частности, уровни р вырождены трехкратно, так как им соответствуют 3 возможных энергетически равноправных состояния, отличающихся значениями магнитного квантового числа ml (при l = 1, ml = -1,0, +1). Уровни d имеют пятикратное вырождение ( ml = -2, -1,0,1,2) и для их максимального заполнения требуется 10 электронов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.