Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами)поляризации связи О-Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
R-COOH = R-COO− + H+ Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Строение карбоксильной группы:
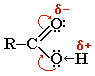
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н. В водном растворе карбоновые кислоты диссоциируют на ионы:
![]()
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
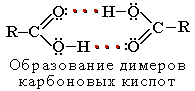
Атом водорода карбоксильной группы отделяется от нее в миллион раз легче, чем от гидроксильной группы фенола. Поэтому всякое органическое вещество, содержащее карбоксильную группу, обладает ярко выраженными кислотными свойствами. Такие вещества носят назв. Если вместо гидроксильной группы присоединить к ней просто атом водорода, то получится альдегидная группа. Альдегиды, которые могут таким путем образовываться из той или иной карбоновой кислоты, получают свое название от названия соответствующей кислоты карбоновых кислот Взгляните еще раз на формулу карбоксильной группы. Вы увидите, что у атома углерода еще остается одна свободная валентная связь, к которой может присоединиться какой-нибудь другой атом. Если это будет атом водорода, то получится муравьиная кислота.
Карбоксильная группа может быть присоединена к углеводородной цепочке любой длины. Однако почти во всех таких соединениях, встречающихся в природе, общее число атомов углерода оказывается четным. Например, в молекуле уксусной кислоты — два атома углерода. Есть карбоновые соединения с четырьмя, шестью, восемью и так далее атомами углерода, их может быть больше двадцати. А аналогичных соединений с нечетным числом атомов углерода в природе почти не бывает.
Изомеры Фталевого ангидрида:
1,5-Бензолкарбоновой кислоты
3,6- Парабензолкарбоновой кислоты
Вывод:
Проанализировав строение молекулы фталевого ангидрида я узнал: что фталевый ангидрид представляет собой бесцветные кристаллы, практически нерастворимые в воде, умеренно растворимые в органических растворителях.
Проявляет свойства ароматических соединений. Со спиртами при нагревании в присутствии серной кислоты образует сложные моно- и диэфиры, с многоатомными спиртами — полиэфиры (алкидные смолы). Фталевый ангидрид является исходным реагентом для получения различных производных фталевой кислоты: её сложных эфиров, фталимида, фталонитрила. Фталевый ангидрид является сырьём для производства глифталевых и пентафталевых красителей производных флуоресцеина, родамина и антрахинона, лекарственных средств. Фталевый ангидрид ядовит, раздражает кожу и слизистые оболочки глаз и носа, способствует заболеванию бронхиальной астмой.
2. Запишите термодинамическое уравнение реакции образования вещества из простых веществ.
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента.
Фталевый ангидрид состоит из таких простых веществ как углерод, кислород, водород.
![]()
Вывод: данное термодинамическое уравнение из простых веществ возможно.
3. Рассчитайте ![]() ,
,
![]() реакции
полного сгорания вещества в атмосфере кислорода. Определите, какое количество
моль вещества, выделится при сгорании
реакции
полного сгорания вещества в атмосфере кислорода. Определите, какое количество
моль вещества, выделится при сгорании
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.