































Альдегидная и кетонная группы также являются ориентантами II рода, обусловливают вступление нитрогруппы преимущественно в м-положение и необходимость проведения реакции в жестких условиях. Однако м-ориентирующее влияние карбонильной группы выражено не столь отчетливо, как у других ориентантов II рода, например у нитрогруппы; бензальдегид нитруется нитратом калия в концентрированной серной кислоте при 0-5 °С или безводной азотной кислотой при –10÷0 °С, и образующийся м-нитробензальдегид легко отделяется от сопутствующего ему о-изомера (до 20%) кристаллизацией:
CHO CHO
![]()
![]()
HNO3
![]()
- H2O ![]()
![]() NO2
NO2
Для получения n-нитробензальдегида можно обработать бензальдегид уксусным ангидридом и образовавшийся ацилаль (бензилидендиацетат) подвергнуть нитрованию нитратом меди в ледяной уксусной кислоте. В этих условиях нитрогруппа вступает в n-положение к сложноэфирной группе, и с высоким выходом (79%) получается n-нитробензилидендиацетат, гидролиз которого дает n-нитробензальдегид:
|
CHO |
CH(OCOCH3)2 |
CH(OCOCH3)2 |
CHO |
|
(CH3CO)2O |
Cu(NO3)2 |
H2O, H |
|
|
+ |
|||
|
CH3COOH |
- 2CH3COOH |
||
|
NO2 |
NO2 |
||
Прямое нитрование ацетофенона нитрующей смесью (азотная кислота d 1.42, серная кислота d 1.84 при 0 ºС) приводит к получению м-нитроацетофенона. Однако и в этом случае ориентирующее влияние карбонильной группы выражено не столь однозначно: если нитровать ацетофенон дымящей азотной кислотой при -10 ÷ -15°С, то получается смесь нитроацетофенонов, состоящая из м-нитроацетофенона и о-нитроацетофенона:
|
COCH3 |
COCH3 |
COCH3 |
|
|
HNO3 |
(d 1.5) |
O2N |
|
|
+ |
|||
|
- H2O |
|||
|
NO2 |
34% |
||
|
55% |
|||

2.3. Применение нитросоединений
Нитросоединения ароматического ряда служат полупродуктами в анилинокрасочной и фармацевтической промышленности, применяются в качестве гербицидов (производные 2,4-динитрофенола), фунгицидов, инсектицидов (нитрофениловые эфиры фосфорной к-ты). Ряд нитроаренов используется в парфюмерии в качестве душистых веществ или фиксаторов запаха. Большое значение имеют синтетические мускусы.
Многие полинитросоединения ароматического ряда широко используются как взрывчатые вещества (например, тринитротолуол, тетрил). Нитропарафины применяются, например, как растворители синтетических смол, смазочных масел, красителей, нитроцеллюлозы.
Большая реакционная способность нитропарафинов позволяет использовать их в качестве промежуточных продуктов в многочисленных синтезах: так, например, кислотный гидролиз нитроалканов приводит к получению карбоновых кислот и гидроксиламина с высокими выходами; частичное восстановление дает возможность по-лучать из них оксимы (получение капролактама из нитроциклогексана); конденсация с альдегидами приводит к нитроспиртам и нитроолефинам и т.д.
В природе нитросоединения встречаются крайне редко. В каче-стве примера можно привести природные антибиотики левомицетин и азомицин (2-нитроимидазол), а также аристолохоловую кислоту, проявляющую противоопухолевую и бактериостатическую активность.
В то же время многие синтетические нитросоединения исполь-зуются в качестве лекарственных препаратов, среди них: антибактериальные препараты (фурацилин, фуразолидон), препараты для лечения протозойных инфекций (метронидазол, нитазол), антигельминтные средства (фенасал), средства, улучшающие кровоснабжение и метаболизм миокарда (нитроглицерин, нитросорбид, тетранитрат пентаэритрита) и др.
|
N |
||||||||||
|
NH2 |
N |
O |
H3C |
N |
NO2 |
|||||
|
O2N |
N |
O2N |
||||||||
|
N |
||||||||||
|
O |
NO |
O |
O |
|||||||
|
H |
||||||||||
|
фурацилин |
фуразолидон |
OH |
||||||||
|
метронидазол |
||||||||||
|
Cl |
||||||||||
|
O |
||||||||||
|
O |
N |
|||||||||
|
N |
H3C |
N |
S |
NO2 |
||||||
|
NO2 |
H |
|||||||||
|
OH |
H |
нитазол |
||||||||
|
Cl |
||||||||||
фенасал
Считается, что во многих случаях успешное использование нитро-замещенных ароматических нитросоединений основано на способно-сти этих веществ избирательно разобщать процессы окислительного фосфорилирования в организмах паразитов и в меньшей степени воз-действовать на соответствующие системы организма человека.
2.4. Техника безопасности при проведении
процессов нитрования.
В большинстве случаев реакция нитрования сопровождается выделением оксидов азота, поэтому работу следует проводить в вытяжном шкафу. Ароматические нитросоединения – яды, действующие на кровь, они могут поглощаться при вдыхании паров и через кожу. Некоторые нитросоединения (динитрохлорбензол), кроме того, сильно раздражают кожный покров, вызывают дерматиты. Поэтому все операции, проводимые с ними, следует выполнять с особой аккуратностью. При попадании веществ на руки немедленно удалить их с поверхности кожи ватным тампоном, а пораженное место промыть большим количеством воды, а затем спиртом. При работе с кислотами следует соблюдать правила техники безопасности работы с едкими веществами.
При первых признаках отравления нитросоединениями – головной боли, слабости, головокружении, посинении губ, кончика носа, ушных раковин – пострадавшего необходимо немедленно вы-вести на воздух и направить в медицинский пункт.
3.Экспериментальная часть
3.1.Бензойная кислота
Методика
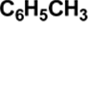
![]()
![]()
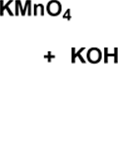
![]()
![]()
![]()
![]()
![]()
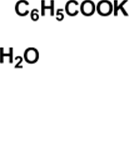 Реактивы:
Реактивы:
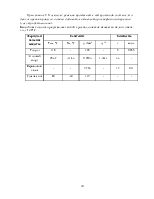
|
Реактивы |
Посуда и приборы |
||||||
|
толуол |
5 г |
круглодонная колба на 1 л |
|||||
|
соляная кислота (к) |
15.6 мл |
колба Бунзена |
|||||
|
этиловый спирт |
2 |
мл |
термометр |
||||
|
вода |
водяная баня |
||||||
|
обратный холодильник |
|||||||
|
фарфоровая чашка |
|||||||
|
воронка для горячего фильтрования воронка Бюхнера |
|||||||
Техника безопасности: В работе используется концентрированная соляная кислота. Необходимо соблюдать осторожность и не допускать ее попада- ния на одежду и открытые участки тела.
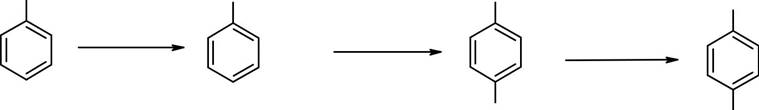
Подготовка прибора для проведения реакции. В штативе закрепляют круглодонную колбу емкостью 1 л, расположенную над электрической плиткой. В колбу помещают 350 мл воды, 0.11 моля толуола и 0.22 моля мелко растертого перманганата калия.
Проведение синтеза. В колбу помещают несколько кусочков пористого фарфора. Смесь нагревают до кипения в течение 4 часов (примечание 1). Если реакционная смесь остается окрашенной по истечении этого времени, в еще горячую массу добавляют 2-3 мл этанола. Смесь охлаждают, выпавший осадок оксида марганца(IV) отфильтровывают и дважды промывают порциями теплой воды по 10-15 мл. Фильтрат упаривают до объема 100 – 150 мл и подкисляют соляной кислотой до сильно кислой реакции (по лакмусу).
Выделение бензойной кислоты. Осадок бензойной кислоты фильтруют через воронку Бюхнера, промывают небольшой порцией холодной воды и высушивают.
Примечание 1. Поскольку реакция протекает в гетерогенной системе, то для ускорения процесса можно добавить катализатор межфазного переноса (соль трибутиламина).
Бензойная кислота представляет собой кристаллическое вещество белого
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.